
【题目】![]() 时,分别向
时,分别向![]() 的氨水、醋酸铵溶液中滴加
的氨水、醋酸铵溶液中滴加![]() 的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是
的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是
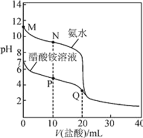
A.M点溶液中:![]()
B.N点溶液中:![]()
C.P点溶液中:![]()
D.Q点溶液中:![]()
【答案】D
【解析】
A. 一水合氨是弱电解质,电离程度较小,一水合氨电离导致溶液呈碱性,水还电离出氢氧根离子,则存在c(NH3H2O)>c(OH)>c(NH4+)>c(H+),故A错误;
B. N点溶液中溶质为等物质的量浓度的一水合氨、氯化铵,混合溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,但是其电离和水解程度都较小,则存在c(NH4+)>c(Cl)>c(NH3H2O)>c(OH),故B错误;
C. P点溶液中溶质为等物质的量浓度的氯化铵、醋酸铵和醋酸,溶液中存在物料守恒c(NH4+)+c(NH3H2O)=c(CH3COO)=2c(Cl),存在电荷守恒c(NH4+)+c(H+)=c(CH3COO)+c(Cl)+c(OH),溶液呈酸性,则c(H+)>c(OH),c(NH4+) <c(CH3COO)+c(Cl)①,由于 c(NH4+)+c(NH3H2O)= 2c(Cl)则0.5c(NH4+)+0.5c(NH3H2O) = c(Cl)②,将②代入①得到c(NH4+)<c(CH3COO)+0.5c(NH4+)+0.5c(NH3H2O),即0.5c(NH4+)<c(CH3COO)+0.5c(NH3H2O),左右两边同时乘以2所以得到c(NH4+)<2c(CH3COO)+c(NH3H2O),故C错误;
D. Q点溶质为等物质的量浓度的氯化铵和醋酸,溶液中存在物料守恒:c(Cl)=c(CH3COOH)+c(CH3COO)、c(Cl)=c(NH4+)+c(NH3H2O)、(CH3COOH)+c(CH3COO)=c(NH4+)+c(NH3H2O),所以存在2c(Cl)=c(CH3COOH)+c(NH4+)+c(CH3COO)+c(NH3H2O),则2c(Cl)〉c(CH3COOH)+c(NH4+),故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】已知:①R-NO2![]() R-NH2,②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。如图是用苯作原料制备一系列化合物的转化关系图:
R-NH2,②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。如图是用苯作原料制备一系列化合物的转化关系图:
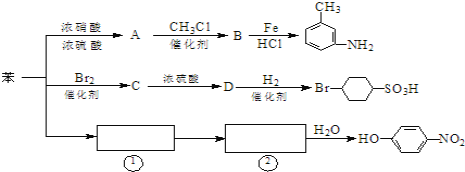
(1)A转化为B的化学方程式是____________________
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:①____,②_____
(3)有机物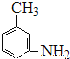 的所有原子___________(填“是”或“不是”)在同一平面上。
的所有原子___________(填“是”或“不是”)在同一平面上。
(4)有机物B苯环上的二氯代物有_____________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为2L的恒容密闭容器中,某一反应中![]() 、
、![]() 、
、![]() 三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
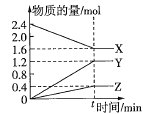
A.反应的化学方程式为![]()
B.t时刻,正、逆反应都不再继续进行,反应达到化学平衡
C.若![]() ,则0~tmin内
,则0~tmin内![]() 的化学反应速率为
的化学反应速率为![]()
D.温度、体积不变,在tmin时充入![]()
![]() 使压强增大,正、逆反应速率都增大
使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.![]() 氦
氦![]() 含有的中子数为
含有的中子数为![]()
B.在![]() 与
与![]() 的混合物中,离子总数为
的混合物中,离子总数为![]()
C.一定条件下,丁烷催化裂化生成![]() 乙烯时,消耗丁烷的数目为
乙烯时,消耗丁烷的数目为![]()
D.已知![]() 溶液呈中性,则
溶液呈中性,则![]() 的
的![]() 溶液中含
溶液中含![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 溶液红色褪去 |
|
B | 分别向盛有 | a中溶液变蓝,b中产生黄色沉淀 |
|
C | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热 | 未见有银镜产生 | 淀粉没有水解 |
D | 向无水乙醇中加入浓硫酸,加热,产生的气体通入酸性 | 溶液紫色褪去 | 气体中含有乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物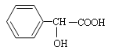 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
A.6 种B.9 种C.15 种D.19 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸HA是一元弱酸,25℃时的电离平衡常数Ka=4.0×10-8。
(1)写出该酸的电离方程式___,其电离平衡常数表达式Ka=____。
(2)25℃时,向1mol·L-1HA溶液中加入1 mol·L-1 盐酸,会____(“抑制”或“促进”)HA的电离,c(H+)____(填“增大”、“减小”或“不变”), 电离平衡常数Ka___(填“增大”、“减小”或“不变”)。
(3)25℃时,若HA的起始浓度为0.01mol·L-1,则平衡时c(H+)=___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com