
【题目】常温下,Na2CO3和NaHCO3的混合溶液中c(![]() )、c(
)、c(![]() )与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )
)与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )

A.图中E点溶液表示浓度均为0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液
B.pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(![]() )
)
C.pH=11的溶液中:c(![]() )<c(
)<c(![]() )
)
D.向E点溶液中加入等体积0.100 mol·L-1的NaOH溶液,c(![]() )与c(
)与c(![]() )之和保持不变
)之和保持不变
【答案】C
【解析】
A. E点表示c(CO32-) = c(HCO3-),碳酸根的水解程度大于碳酸氢根,0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液不能使c(CO32-) = c(HCO3-),故A错误;
B. 根据物料守恒c(HCO3-)+c(CO32-)+c(H2CO3)=0.100mol/L和电荷守恒c(H+)+c(Na+)=c(OH-)+2c(CO32-)+ c(HCO3-)可知pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(CO32-)+0.100mol·L-1,故B错误;
C. 碳酸根的水解程度大于碳酸氢根,因此碳酸根的浓度越大,pH越大。二者浓度相等时,溶液的pH>10,因此pH=11的溶液中: c(Na2CO3) > c(NaHCO3), 故C正确;
D. 在E点溶液中加入等体积0.100mol·L-1的NaOH溶液碳酸氢钠转化为碳酸钠,根据物料守恒可知c(CO32-)与c(HCO3-)之和发生变化,故D错误;
正确答案是C。


科目:高中化学 来源: 题型:
【题目】某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 | ① | ② | ③ | ④ |
实验 内容 |
|
|
|
|
一周后观察:
(1)铁钉被腐蚀程度最大的是___(填实验序号)。
(2)实验③中主要发生的是____(填“化学腐蚀”或“电化学腐蚀”)。
(3)烧过菜的铁锅未及时洗净(含氯化钠的残留液),第二天便出现红棕色锈斑,试写出有关的电极反应式: 负极____;
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是____。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有___(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬 ③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 恒容密闭容器中进行的反应:A(s)+3B(g)![]() 2C(g)+D(g),如果气体密度保持不变,说明反应已经达到平衡
2C(g)+D(g),如果气体密度保持不变,说明反应已经达到平衡
B. C ( s) + H2O (g) ![]() CO ( g) + H2 (g),其他条件不变,缩小容器体积,正速率减小,逆速率增大
CO ( g) + H2 (g),其他条件不变,缩小容器体积,正速率减小,逆速率增大
C. N2(g) + 3H2(g)![]() 2NH3(g) △H=—93kJ·mol—1,往恒容密闭容器中充入0.4 molN2(g)和2 mol H2(g)达到平衡时,可以放出37.2 kJ的热量
2NH3(g) △H=—93kJ·mol—1,往恒容密闭容器中充入0.4 molN2(g)和2 mol H2(g)达到平衡时,可以放出37.2 kJ的热量
D. A(g)+ 3B (g) ![]() 2C (g) + D (g),在两种不同情况下的反应速率分别为:①
2C (g) + D (g),在两种不同情况下的反应速率分别为:①![]() ,②
,②![]() ,则前者比后者快
,则前者比后者快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钪![]() 广泛应用在合金电光源,催化剂,激活剂等领域,下列流程图是用钪精矿生产氧化钪的方法之一:
广泛应用在合金电光源,催化剂,激活剂等领域,下列流程图是用钪精矿生产氧化钪的方法之一:![]() 钪精矿主要成分是钪的氧化物,硅铁等氧化物
钪精矿主要成分是钪的氧化物,硅铁等氧化物![]()
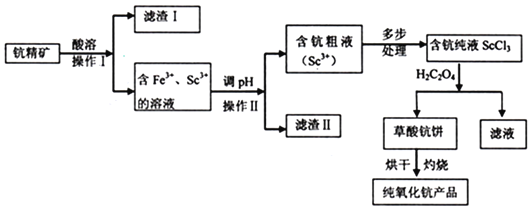
回答下列问题:
![]() 滤渣I是______
滤渣I是______![]() 填化学式
填化学式![]() 。在实验室里,操作Ⅰ必要的玻璃仪器有烧杯、______。
。在实验室里,操作Ⅰ必要的玻璃仪器有烧杯、______。
![]() 调pH的目的是______,如何检验含钪粗液中不含
调pH的目的是______,如何检验含钪粗液中不含![]() 离子______。
离子______。
![]() 写出制取草酸钪饼的化学方程式______。
写出制取草酸钪饼的化学方程式______。
![]() 写出草酸钪饼在空气中灼烧的化学方程式______,每生成
写出草酸钪饼在空气中灼烧的化学方程式______,每生成![]() ,转移的电子数为______。
,转移的电子数为______。
![]() 某工厂用
某工厂用![]() 的钪精矿制备纯氧化钪,得到纯产品
的钪精矿制备纯氧化钪,得到纯产品![]() ,则钪精矿中钪的质量分数是______
,则钪精矿中钪的质量分数是______![]() 假设Sc的利用率为
假设Sc的利用率为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和醋酸溶液,各加入生铁块,放置一段时间。下列有关描述不正确的是

A.生铁块中的碳是原电池的正极
B.红墨水水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e- = Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯的实验装置如图所示,下列说法正确的是( )

A.试管A中,依次加入的是浓硫酸、乙醇、乙酸
B.B中加入的是饱和Na2CO3溶液
C.B中的导管也可以伸入到液面以下
D.实验结束,B的下层出现少量油层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为___________________________________________。
(3)母液中溶质主要成分的化学式为_____________________________________________。
(4)将标准状况下1.12L炉气通入100mL 0.5mol·L-1NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为____________________________。
(5)检验废渣中主要成分的方法是_____________________________________________________(写出操作步骤、现象及结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠俗称红矾钠![]() ,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
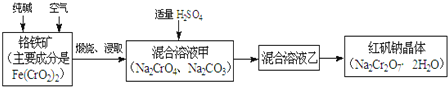
(1)化学上可将某些盐写成氧化物的形式,如![]() 可写成
可写成![]() ,则
,则![]() 可写成______.
可写成______.
(2)煅烧铬铁矿时,矿石中难溶的![]() 生成可溶于水的
生成可溶于水的![]() ,反应化学方程式如下:
,反应化学方程式如下:![]() 为了加快该反应的反应速率,可采取的措施是______
为了加快该反应的反应速率,可采取的措施是______![]() 写一种即可
写一种即可![]()
(3)已知![]() 在不同的酸性溶液中有不同的反应,如:
在不同的酸性溶液中有不同的反应,如:
![]() ;
;![]()
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(4)在含![]() 废水中存在着平衡:
废水中存在着平衡:![]() ,请写出该平衡的平衡常数表达式
,请写出该平衡的平衡常数表达式![]() ______,若继续加水稀释,平衡将______移动
______,若继续加水稀释,平衡将______移动![]() 填“正向”、“逆向”“不”
填“正向”、“逆向”“不”![]() .
.
(5)请配平碱性溶液还原法中发生的离子反应:
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是( )

A.Fe+4H++NO3-=Fe3++NO↑+2H2O
B.Fe(OH)3+3H+=Fe3++3H2O
C.Fe3O4+8H+=Fe2++2Fe3++4H2O
D.3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com