
| A. | 硝酸比磷酸易挥发 | |
| B. | 金刚石的熔点比晶体硅高 | |
| C. | 惰性气体一般很难发生化学反应 | |
| D. | 通常情况下单质溴呈液态、碘呈固态 |
分析 A、硝酸和磷酸的挥发性与它们的分子间作用力有关;
B、原子晶体的熔点与键能大小有关;
C、稀有气体的原子最外层(氦2电子稳定结构)达到了8电子稳定结构;
D、常温常压下,溴和碘的聚集状态与分子间作用力有关.
解答 解:A、分子间作用力的大小与分子的式量成正比,硝酸的式量为63,硫酸的式量为98,硝酸易挥发,硝酸分子间作用力比硫酸的分子间作用力小,故硝酸易挥发,硫酸难挥发,挥发的难易与化学键无关,故不能用键能大小解释,故A错误;
B、金刚石和晶体硅都属于原子晶体,其熔点由键能决定,键能越大熔点越高,故B正确;
C、稀有气体的原子最外层(氦2电子稳定结构)达到了8电子稳定结构,很难与其它原子反应,稀有气体只存在分子间作用力,没有化学键,故不能用键能大小解释,故C错误;
D、常温常压下,溴分子与溴分子间存在分子间作用力,碘分子与碘分子间存在分子间作用力,分子间作用力的大小,决定物质的聚集状态是气态、液态、还是固态,与化学键无关,故D错误;
故选B.
点评 本题考查键能的应用,涉及物质熔沸点的判断、溶解度大小比较等知识,难度不大,注意概念的理解应用.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:多选题
| 选项 | 需要区分的物质 | 实验方法 | |
| A | 磷酸钙和氯化铵 | 溶于水 | 与熟石灰混合研磨 |
| B | 氢氧化钠固体和熟石灰 | 将两种固体溶于水 | 溶于水,向所得溶液中分别吹入CO2气体 |
| C | 硫酸钾和碳酸钾 | 加硝酸钡溶液 | 加水溶解 |
| D | 硬水和软水 | 肥皂水 | 加热、煮沸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
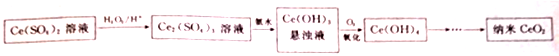
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业炼铁:需要用到的原料有铁矿石、焦炭、空气和生石灰 | |
| C. | 冶炼镁:将六水合氯化镁晶体在一定条件下加热得到无水氯化镁,电解熔融氯化镁,可以得到金属镁 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融烧碱时不能使用石英坩埚:SiO2+2NaOH$\stackrel{△}{→}$ Na2SiO3+H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+→I2+O2↑+4H2O | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g) $\stackrel{高温}{→}$Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+→Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
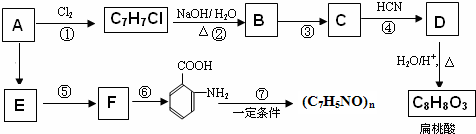
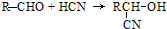
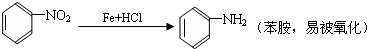
 ;扁桃酸
;扁桃酸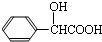 .
. .
. .
.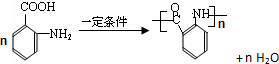 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
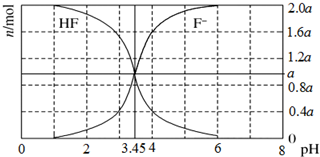 25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3.45时,溶液中:c(Na+)+c(H+)=c(HF)+c(OH-) | |
| B. | pH=3时,溶液中:c(Na+)>c(F-) | |
| C. | n(F-)=0.6a mol时,溶液中:c(Na+)>c(HF) | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| B. | 将③、④分别稀释到pH=5,由水电离出氢离子的浓度均减小100倍 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)>1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com