
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
有效成分 NaClO
规格 1 000 ml
质量分数 25%
密度 1.19 g·cm-3
(1)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL该消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
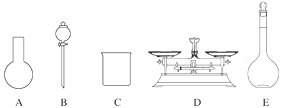
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(3)配制溶液的过程如下,该同学的错误步骤有(____)
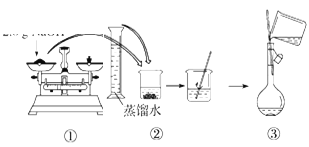
A.1处 B.2处 C.3处 D.4处
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。需用浓硫酸的体积为____mL。
【答案】 0.04 C B 250
【解析】(1)c(NaClO)=c=![]() =
=![]() =4.0 molL-1;稀释前后溶液中NaClO的物质的量不变,则有:100 mL×10-3 LmL-1×4.0 molL-1=100 mL×100×10-3 LmL-1×c(NaClO),解得稀释后c(NaClO)=0.04 molL-1,c(Na+)=c(NaClO)=0.04 molL-1;
=4.0 molL-1;稀释前后溶液中NaClO的物质的量不变,则有:100 mL×10-3 LmL-1×4.0 molL-1=100 mL×100×10-3 LmL-1×c(NaClO),解得稀释后c(NaClO)=0.04 molL-1,c(Na+)=c(NaClO)=0.04 molL-1;
(2)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、不需要,但还需玻璃棒和胶头滴管,故A错误;B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 molL-1×74.5 gmol-1=149 g,故D错误;故答案为C;
(3)在第③步和第④步之间还需要洗涤烧杯和玻璃杯,第⑤定容时,视线要与容量瓶中的凹液面相平,所以总共两处错误,故选B;
(4)溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=![]() =18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL。
=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL。


科目:高中化学 来源: 题型:
【题目】下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合形成稳定化合物的是( )
A. 10与19 B. 6与16 C. 11与17 D. 14与8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的物质,其中甲、乙为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是( )
![]()
A. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序一定为甲<丙<戊
B. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙可能为Na2O2
C. 若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白性
D. 若甲既能与盐酸反应又能与NaOH溶液反应,则戊可能属于两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。右图为RFC工作原理示意图,则有关说法正确的是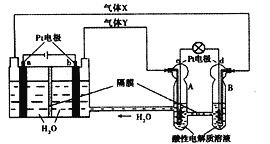
A. 当有0.1mol电子转移时,a极产生1.12LO2(标准状况下)
B. b极上发生的电极反应是:4H2O+4e―=2H2↑+4OH―
C. d极上发生的电极反应是:O2+4H++4e―=2H2O
D. c极上进行还原反应,B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:

(1)则25 ℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由________________。
(2)在25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是_______________________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)装置A中仪器①的名称是__________,装置B中仪器②的名称是__________, 装置D中仪器③的名称是___________。
(2) 从碳酸钙和氯化钠固体混合物中得到纯净氯化钠固体,应选择装置___________(填代表装置图的字母,下同);从海水中获得淡水可选择装置____________;从碘水中分离出I2,应选择装置___________,该分离方法的名称为_________________。
(3)实验室中制取的Fe(OH)3胶体中常常含有杂质Fe3+、Cl-离子。可用________方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧可与多种元素形成化合物,设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 7.2 g CaO2晶体中阴离子数目为0.2NA
B. 4.0 g H![]() O中所含电子数为2NA
O中所含电子数为2NA
C. 6.2 g Na2O溶于100 mL水中所得溶液的物质的量浓度为2 mol·L-1
D. 标准状况下,将22.4 L Cl2通入足量水中发生反应,转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的几种物质:①Cu②熔融NaCl③NaHSO4④CO2⑤H2SO4⑥酒精⑦KHCO3溶液⑧BaSO4⑨液氨。请按下列分类标准回答问题。
(1)属于电解质的是________________;(2)非电解质的是______________;(3)能导电的是_____;
(4)写出下列物质的电离方程式:NaHCO3:____________________________;NaHSO4(熔融): _________;A12(SO4)3_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com