
| A、未洗涤烧杯和玻璃棒 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、定容时俯视液面 |
科目:高中化学 来源: 题型:

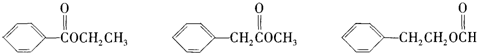
查看答案和解析>>
科目:高中化学 来源: 题型:
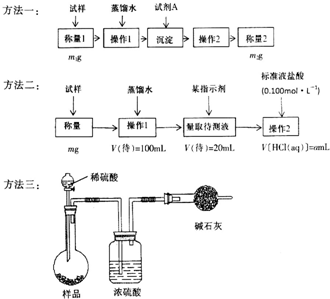 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.查看答案和解析>>
科目:高中化学 来源: 题型:
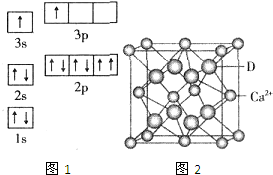 已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
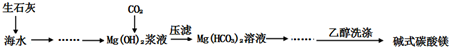
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )| A、①②④ | B、①②④⑥ |
| C、①②④⑤⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将乙酸和乙醇混合加热制乙酸乙酯 |
| B、苯和浓溴水反应制溴苯 |
| C、CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D、用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
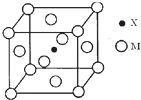 元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
元素X基态原子的p电子比s电子少1个.元素Y基态原子的2p电子是2s电子的2倍.元素Z的一种单质为自然界硬度最大的物质.元素M位于第四周期,其基态原子失去3个电子后3d轨道半满.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com