
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ③④ |
分析 ①催化剂只改变反应速率,但平衡不移动;
②活化能越低反应速率越快;
③因为Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固,使用氟化物,增大了F-的浓度,促进了Ca(PO4)3F的生成,所以当牙膏中配有氟化物添加剂后能防止龋牙;
④一氧化碳和血红蛋白结合的能力强,在氧气浓度大的情况下,血红蛋白与氧气结合.
解答 解:①催化剂只改变反应速率,但平衡不移动,所以催化剂不能提高合成氨工业中原料的转化率,故错误;
②活化能越低反应速率越快,所以氟氯烃在臭氧分解中起催化作用,故正确;
③因为Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固,使用氟化物,增大了F-的浓度,促进了Ca(PO4)3F的生成,所以当牙膏中配有氟化物添加剂后能防止龋牙,所以氟化物防止龋齿所涉及到的化学原理其实就是转化更坚固Ca(PO4)3F,故正确;
④一氧化碳和血红蛋白结合的能力强,在氧气浓度大的情况下,血红蛋白与氧气结合,所以是平衡的移动,故正确;
故选 B.
点评 本题考查外界条件对化学速率和平衡移动的影响,平衡移动的影响因素因素分析判断,来解决生活中的相关实例,题目难度中等.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
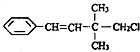 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )| A. | 一定条件下,能发生加聚反应 | |
| B. | 1mol该有机物在一定条件下最多能与4molH2发生反应 | |
| C. | 能使酸性KMnO4溶液、溴水褪色,且原理相同 | |
| D. | 该有机物苯环上的一溴代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠浮在煤油层上,不反应 | |
| B. | 钠沉在煤油层下,不反应 | |
| C. | 钠沉在煤油层下浮在水层上,在交界处剧烈反应 | |
| D. | 钠沉在水层下剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CaCl2溶液中通入CO2至过量 | |
| B. | 向AlCl3溶液中滴加氨水溶液至过量 | |
| C. | 向氢氧化铁胶体中滴加稀硫酸至过量 | |
| D. | 向Na2SiO3溶液中滴加盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| B. | MgCO3与NaOH溶液反应生成沉淀:MgCO3+2OH-═Mg(OH)2↓+CO32- | |
| C. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 向NH4HSO4溶液中滴加过量NaOH溶液:NH4++HSO4-+2OH-═SO42-+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用水洗净后,在干燥箱中 干燥 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线 | |
| D. | 定容后,盖好瓶塞,用食指顶住瓶塞,手握住瓶进颈,左右振荡摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com