
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
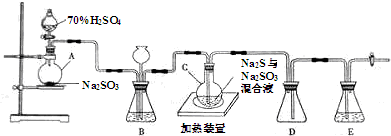
分析 (1)液柱高度保持不变,说明气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3;
(3)SO2易溶于水,能与Na2SO3溶液、NaHCO3溶液反应,但在NaHSO3溶液中溶解度较小;
(4)加入盐酸,Na2S2O3反应生成S沉淀,所以静置后取上层清液,滴加BaCl2溶液,检验溶液中是否含有硫酸根离子;
(5)硫酸的用量一定,由上述二氧化硫的体积可知,第一份、第二份中海波样品完全反应,生成2.24LL二氧化硫需要海波质量为12.6g×$\frac{2.24L}{1.12L}$=25.2g<28.00,故第三份中硫酸不足,结合反应:S2O32-+2H+=S↓+SO2↑+H2O计算硫酸的物质的量,进而计算硫酸的物质的量浓度.
解答 解:(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)SO2易溶于水,能与Na2SO3溶液、NaHCO3溶液反应,但在NaHSO3溶液中溶解度较小,故选:c;
(4)检测产品中是否存在Na2SO4的实验方案为:取少量产品溶于足量稀盐酸、静置、取上层清液(或过滤,取滤液)、滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸、静置、取上层清液(或过滤,取滤液)、滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(5)硫酸的用量一定,由上述二氧化硫的体积可知,第一份、第二份中海波样品完全反应,生成2.24LL二氧化硫需要海波质量为12.6g×$\frac{2.24L}{1.12L}$=25.2g<28.00,故第三份中硫酸不足,生成二氧化硫的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,结合反应:S2O32-+2H+=S↓+SO2↑+H2O,可知n(H+)=2n(SO2)=0.2mol,故n(H2SO4)=$\frac{1}{2}$n(H+)=0.1mol,则硫酸的物质的量浓度为$\frac{0.1mol}{0.02L}$=5mol/L,
故答案为:5mol/L.
点评 本题考查实验方案的分析与评价,涉及气密性检验、离子检验、对操作的分析评价、化学计算等,侧重实验分析能力及知识综合应用能力的考查,(2)为易错点,可以利用总反应的分析,题目难度中等.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 改变条件 | 平衡移动方向 | 导电能力 |
| A | 加入蒸馏水 | 逆向移动 | 减弱 |
| B | 加入少量冰醋酸 | 正向移动 | 增强 |
| C | 加入少量CH3COONa固体 | 正向移动 | 增强 |
| D | 加入少量0.1mol•L-1的稀硫酸 | 逆向移动 | 减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液与NaOH溶液共热.产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液中含CO32- | |
| C. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时.火焰呈黄色,说明原溶液中只含有Na+,不含有K+ | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中存在SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与硝酸反应:Fe3O4+8H+ ═Fe2++2Fe3++4H2O | 书写正确 |
| B | 工业制粗硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | 错误,生成物应是Si和CO |
| C | NaAlO2溶液与少量CO2反应: AlO2- ̄+CO2+2H2O═HCO3- ̄+Al(OH)3↓ | 书写正确 |
| D | NaHCO3溶液中加入少量石灰水:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O | 错误,生成物 中不含CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 4个Cl-和2个NH3分子均与Pt4+配位 | |
| D. | 配合物中4个Cl-与Pt4+配位,而2个NH3分子与Pt4+不配位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中露置会立刻被空气氧化成过氧化钠 | |
| B. | 钠单质具有强还原性,可将铜从其盐溶液中置换出来 | |
| C. | 钠与钠离子都具有强的还原性 | |
| D. | 钠与稀盐酸反应的实质是与氢离子的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com