
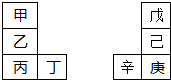
| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
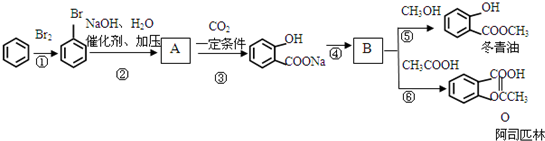
查看答案和解析>>
科目:高中化学 来源: 题型:
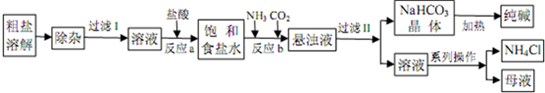
| 等级 | 优等品 | 一等品 | 合格品 |
| Na2CO3含量 | ≥99.2 | ≥98.8 | ≥98.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度减小 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、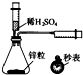 测定一定时间内生成H2的反应速率 |
B、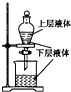 提取海带中的碘 |
C、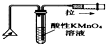 检验火柴燃烧产生的SO2 |
D、 证明非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
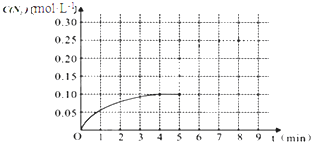
查看答案和解析>>
科目:高中化学 来源: 题型:
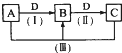 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com