
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 等物质的量的氯气与乙烷在光照条件下反应(一氯乙烷) | |
| D. | 液溴与苯用溴化铁作催化剂反应(溴苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中未成对电子最多的元素 |
| G的3d能级只含有2对成对电子 |
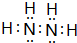 .
. 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:
水合肼(N2H4•H2O)为无色透明的油状液体,沸点为118.5℃,熔点为-40℃.具有强碱性,在空气中可吸收CO2,产生烟雾.水合肼是一种强还原剂,能与卤素单质、HNO3、KMnO4等激烈反应.水合肼可用含NaOH的NaClO溶液氧化尿索[CO(NH2)2]溶液制得.实验室模拟水合肼的制备装置如图所示(夹持及加热装置已省略).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0g D218O中含有的质子数为NA | |
| B. | 标准状况下,22.4L NH3分子含有的杂化轨道数为4NA | |
| C. | 78g Na2O2晶体中所含阴、阳离子个数均为2NA | |
| D. | 1mol Fe完全溶于一定量的硝酸溶液中,转移的电子数一定是3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com