
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
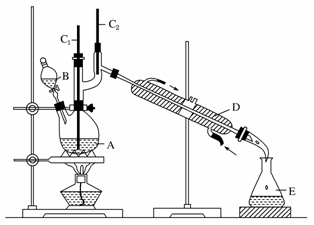
发生的反应如下:
CH3CH2CH2CH2OH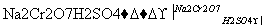 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由________________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是_______________________________________________________ ______________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是________________________。
(7)本实验中,正丁醛的产率为________%。
科目:高中化学 来源: 题型:
右图是测定空气中氧气含量的装置,请回答下列 问题:
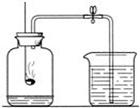 (1)有关反应的文字表达式或符号表达式为
(1)有关反应的文字表达式或符号表达式为
(2)冷却后,打开止水夹,可观察到的现象是
(3)下列说法正确的是 (填字母)
A.燃烧匙中的红磷越多,水位上升越高
B.不可以用木炭代替红磷进行相同实验
C.本实验可以证明空气含有N2、O2、CO2
(4)已知五氧化二磷溶于水且化学性质与二氧化碳相似,
反应完毕后振荡集气瓶再滴入紫色石蕊溶液,溶液变  色。
色。
查看答案和解析>>
科目:高中化学 来源: 题型:
把太阳光变成激光可用于分解海水制氢气:2H2O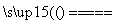 2H2↑+O2↑。下列说法正确的是( )
2H2↑+O2↑。下列说法正确的是( )
A.水的分解反应是放热反应
B.氢气是一次能源
C.使用氢气作燃料将会增加温室效应
D.在这一反应中,光能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验不能达到目的的是( )
A.用溴水鉴别乙醇、苯和四氯化碳
B.用饱和氢氧化钠溶液除去乙酸乙酯中少量乙酸
C.用葡萄糖的特征反应来检验尿液中是否含有葡萄糖
D.用油脂在碱性条件下水解制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与有机物的结构、性质有关的叙述正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程都与热量变化有关,其中表述不正确的是( )
|
| A. | CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO(g)+ |
|
| B. | 稀盐酸和稀氢氧化钠溶液反应的中和热为57.3kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为 |
|
| C. | 铝热反应是放热反应,但需要足够的热量才能使反应发生 |
|
| D. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L的密闭容器中,发生以下反应:2A(g) + B(g) 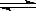 2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 s A的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是
2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 s A的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是
A.0.6 mol B.1.2 mol C.2.4 mol D.1.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能
发电过程中具有重要的作用。下列关于硅及其化合物的说法正确的是( )
A.水泥、玻璃、水晶饰物都是硅酸盐制品
B.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
C.透闪石的化学成分为Ca2Mg5Si8O22(OH)2写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O
D.自然界中硅元素的贮量丰富,并存在大量的单质硅
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米氧化铝在人工晶体、微电子器件等方面有重要应用,实验室制取纳米氧化铝方法之一是:将一定体积的0.3mol·L-1Al(NO3)3溶液匀速滴加到2.0mol·L-1 (NH4)2CO3溶液中,搅拌30min,过滤、纯水洗涤、乙醇洗涤、室温真空干燥,得碱式碳酸铝铵[化学式可表示为:(NH4)aAlb(OH)c(CO3)d],然后热分解得到纳米氧化铝。
(1)制取纳米氧化铝时匀速滴加Al(NO3)3溶液并不断搅拌,其主要目的是
。
(2)(NH4)aAlb(OH)c(CO3)d中a、b、c、d的代数关系式为 。
(3)为确定碱式碳酸铝铵的组成,进行如下实验:
①准确称取5.560g样品,在密闭体系中充分加热到300℃使其完全分解且固体质量不再变化;
②产生的气态物质依次通过足量浓硫酸和碱石灰装置吸收,碱石灰装置增重1.760g;
③最后称得剩余固体质量为2.040g。
根据以上实验数据计算碱式碳酸铝铵样品的化学组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com