
如下图所示装置,若将胶头滴管中的水挤入集气瓶中,请描述观察到的现象并写出有关的离子方程式。
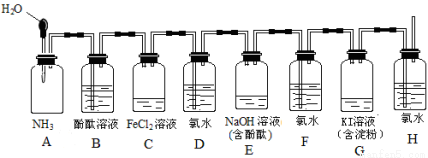
(1)A中的现象为 ,
离子方程式 。
(2)C中的现象为 ,
离子方程式 。
(3)E中的现象为 ,
离子方程式 。
(4)G中的现象为 ,
离子方程式 。
科目:高中化学 来源:2016届辽宁省分校高三上期中测试理综化学试卷(解析版) 题型:选择题
下列有关物质的分类或归类中正确的是( )
A.化合物:HT、CaCl2、NaOH、盐酸
B.纯净物:水玻璃、胆矾晶体、液氯、硫酸
C.天然高分子化合物:淀粉、纤维素、蛋白质、聚氯乙烯
D.同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上二调考试化学试卷(解析版) 题型:选择题
从下列事实所列出的相应结论正确的是( )
实验事实 | 结论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | SO2通过硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32<AlO2- |
D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上二次月考化学试卷(解析版) 题型:填空题
高温下CuO(s)+CO(g) Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
Cu(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:1000℃ K=4.0 1150℃ K=3.7 1300℃ K=3.5 ;请回答下列问题:
(1)该反应的平衡常数表达式___________.
(2)在一个容积为2L的密闭容器中,1000℃时加入Cu、 CuO、CO、CO2各0.2 mol,反应经过10min后达平衡。求该时间范围内反应的平均反应速率v(CO2)﹦ 。
(3)以下措施中,能使反应(2)中的正反应速率显著加快同时不影响CO的平衡转化率的是 (填字母序号)。
A、增加CO的浓度 B、增加CuO的量 C、移出部分CO2 D、提高反应温度 E、减小容器的容积
(4)1000℃时测得在2L的密闭容器中反应体系中某时刻各物质的物质的量见下表:
CuO | CO | Cu | CO2 |
0.8mol | 0.4mol | 0.6mol | 0.6mol |
此时反应中正、逆反应速率的关系式是 (填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应: 2CH3OH(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的逆反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.达到平衡时,容器Ⅰ中的压强与容器Ⅲ中的压强相同
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:选择题
部分弱酸的电离平衡常数如下表:
弱酸 | H2CO3 | H2SO3 | HClO |
电离平衡常数 (25℃) | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 | K=2.95×10-8 |
下列说法不正确的是( )
A.NaHSO3溶液中的离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
B.相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3
C.ClO-+CO2+H2O=HClO+HCO3-
D.2ClO-+SO2+H2O=2HClO+SO32-
查看答案和解析>>
科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
将NaOH溶液逐滴加入NH4HCO3溶液中(忽略溶液体积的变化),下列各示意图表示的混合溶液有关量的变化趋势正确的是
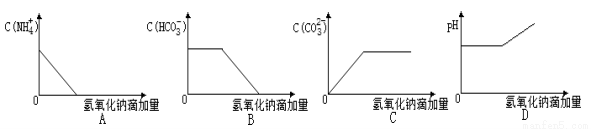
查看答案和解析>>
科目:高中化学 来源:2016届云南玉溪第一中学高三上学期期中考试理化学试卷(解析版) 题型:填空题
下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题:

(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为_______________。
3CO2+4Al,则阳极的电极反应式为_______________。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________。(热回收效率= 回收能量/生产耗能x100%)
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期12月第四次月考化学试卷(解析版) 题型:选择题
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是 ( )
A. X2YZ4 B. XYZ3 C. X3YZ4 D. X4Y2Z7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com