
【题目】黄铜矿(CuFeS2)是炼铜的主要矿物,在野外很容易被误会为黄金,因此被称为愚人金。回答下列问题:
(1)处于激发态的S原子,其中1个3s电子跃迁到3p轨道上,该激发态S原子的核外电子排布式为__。同族元素的氢化物中,H2O比H2Te沸点高的原因是__。
(2)检验Fe2+的试剂有多种,其中之一是铁氰化钾(K3[Fe(CN)6]),又称赤血盐。
①在配合物K3[Fe(CN)6]中,易提供孤电子对的成键原子是__(填元素名称),含有12molσ键的K3[Fe(CN)6]的物质的量为__mol。
②赤血盐中C原子的杂化方式为__;C、N、O三种元素第一电离能由大到小的排序为___;写出与CN-互为等电子体的一种化合物的化学式__。
③Fe、Na、K的晶胞结构相同,但钠的熔点比钾更高,原因是___。
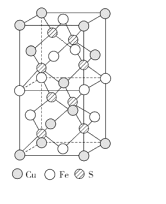
(3)CuFeS2的晶胞结构如图所示。已知:晶胞参数a=0.524nm,c=1.032nm。则CuFeS2的晶胞中每个Cu原子与__个S原子相连,晶体密度ρ=__g·cm-3(列出计算表达式)。
【答案】1s22s22p63s13p5 H2O分子之间存在氢键 碳 1 sp N>O>C CO Na的半径小,形成的金属键键能大,熔点高 4 ![]()
【解析】
分子间若存在氢键,则分子的沸点较高。在配合物K3[Fe(CN)6]中,中心原子为Fe3+,CN-为配体提供孤对电子,一个叁键中含有一个σ键。根据CuFeS2的晶胞结构图可知,每个铜原子与4个硫原子相连,铜原子位于晶胞的顶点、面和体内,硫原子全部位于体内,铁原子位于和棱上。
(1)基态S原子核外电子排布式为1s22s22p63s23p4,处于激发态的S原子,其中1个3s电子跃迁到3p轨道上,则该激发态的S原子核外排布式为1s22s22p63s13p5;因为H2O分子之间存在氢键,而H2Te分子之间只有分子间作用力,因此H2O的沸点比H2Te的沸点最高。
(2)①在配合物K3[Fe(CN)6]中,中心原子为Fe3+,CN-为配体,存在6个配位键,易提供孤电子对的成键原子是C,C与N之间为叁键,其中一个键为σ键,故1个K3[Fe(CN)6]中含有12个含有σ键,则含有12molσ键的K3[Fe(CN)6]的物质的量为1mol。
②赤血盐的CN-中C原子价层电子对个数=1+![]() (4+1-1×3)=2,所以采取sp杂化;C、N、O三种元素的第一电离能随核电荷数递增呈增大趋势,但因N的2p轨道为半充满结构,不易失去电子,因此C、N、O三种元素第一电离能由大到小的排序为N>O>C;CN中有两个原子,电子数为14,其互为等电子体的化合物的化学式为CO。
(4+1-1×3)=2,所以采取sp杂化;C、N、O三种元素的第一电离能随核电荷数递增呈增大趋势,但因N的2p轨道为半充满结构,不易失去电子,因此C、N、O三种元素第一电离能由大到小的排序为N>O>C;CN中有两个原子,电子数为14,其互为等电子体的化合物的化学式为CO。
③Fe、Na、K的晶胞结构相同,但钠的熔点比钾更高,是因为Na的半径小,形成的金属键键能大,熔点高。
(3)根据CuFeS2的晶胞结构图可知,每个铜原子与4个硫原子相连;该晶胞中铜原子的个数为![]() ,铁原子的个数为
,铁原子的个数为![]() ,硫原子的个数为8,因此化学式为CuFeS2,晶体密度ρ=
,硫原子的个数为8,因此化学式为CuFeS2,晶体密度ρ=![]() =
=![]()


科目:高中化学 来源: 题型:
【题目】有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素。其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。在熔融状态下,将Z的单质和FeG2(元素G和铁构成的某化合物)组成一个可充电电池(装置示意图如下),反应原理为:2Z +FeG2![]() Fe+2ZG
Fe+2ZG
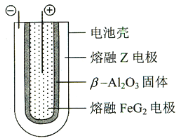
放电时,电池的正极反应式为:______________;充电时,接电源负极的电极材料是____(写物质名称),该电池的电解质为_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.能与NaOH溶液反应的同分异构体共有6种
B.存在分子中含有六元环的同分异构体
C.既含有羟基又含有醛基的有5种
D.不存在含有2个羟基的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为 -5.5℃,易水解。已知:AgNO2 微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
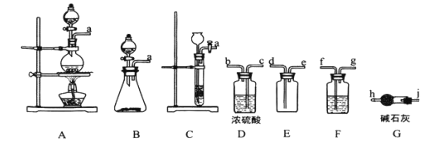
(1)制备 Cl2 的发生装置可以选用 _________ (填字母代号)装置,发生反应的离子方程式为________________________________________ 。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→_______→______→ _____→________→_______→______→______→______。(按气流方向,用小写字母表示,根据需要填,可以不填满,也可补充)。
(3)实验室可用下图示装置制备亚硝酰氯。其反应原理为:Cl2+2NO=2ClNO
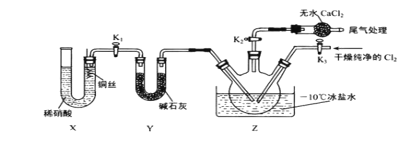
①实验室也可用 B 装置制备 NO , X 装置的优点为___________________ 。
②检验装置气密性并装入药品,打开 K2,然后再打开 K3,通入一段时间气体,其目的是 ___________________,然后进行其他操作,当 Z 中有一定量液体生成时,停止实验。
(4)已知:ClNO 与 H2O 反应生成 HNO2 和 HCl。
①设计实验证明 HNO2 是弱酸:_________________________________________。(仅提供的试剂:1 molL-1 盐酸、 1 molL-1HNO2 溶液、 NaNO2 溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO 样品的纯度。取 Z 中所得液体m g 溶于水,配制成 250 mL 溶液;取出 25.00 mL 样品溶于锥形瓶中,以 K2CrO4 溶液为指示剂,用 c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。滴定终点的现象是_____亚硝酰氯(ClNO)的质量分数为 _________。(已知: Ag2CrO4 为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是_________。
(2)混合气体的平均摩尔质量是_________。
(3)CO2和CO的体积之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
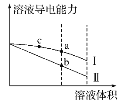
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体, 具刺鼻恶臭味,遇水分解,某学习小组用 C12 和 NO 制备 NOCl 装置如图。下列说法错误的是
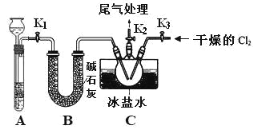
A.氯气在反应中做氧化剂
B.装入药品后,要先打开 K2、K3,反应一段时间后,再打开 K1
C.利用 A 装置还可以做 Na2O2 和水制氧气的实验
D.若没有 B 装置,C 中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有利于可持续发展的生态环境是全国文明城市评选的测评项目之一。
(1)已知反应 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) v 正=k 正·c2(NO)·c2(CO),v 逆=k 逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=
N2(g)+2CO2(g) v 正=k 正·c2(NO)·c2(CO),v 逆=k 逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。一定条件下进行该反应,测得 CO 的平衡转化率与温度、起始投料比m=![]() 的关系如图 1 所示。
的关系如图 1 所示。

①达到平衡后,仅升高温度,k正增大的倍数________填“>”“<”或“=”)k逆增大的倍数。
②下列说法正确的是_______。
A 投料比:m1<m2<m3
B 汽车排气管中的催化剂可提高 NO 的平衡转化率
C 当投料比 m=2 时,NO 转化率比 CO 转化率小
D 当体系中 CO2 和 CO 物质的量浓度之比保持不变时,反应达到平衡状态
③若在 1L 的密闭容器中充入 1 molCO 和 1 mol NO,在一定温度下达到平衡时,CO 的转化率为 40%, 则 k 正︰k 逆=_______(填写分数即可,不用化简)
(2)在 2L 密闭容器中充入 2mol CO 和 1mol NO2,发生反应 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,如图 2 为平衡时 CO2 的体积分数与温度、 压强的关系。
N2(g)+4CO2(g) ΔH<0,如图 2 为平衡时 CO2 的体积分数与温度、 压强的关系。
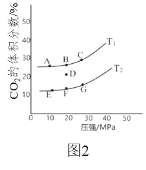
①该反应达到平衡后,为在提高反应速率同时提高 NO 的转化率,可采 取的措施有______(填字母序号)
a 增加 CO 的浓度 b 缩小容器的体积 c 改用高效催化剂 d 升高温度
②若在 D 点对反应容器降温的同时缩小体积至体系压强增大,达到的平衡状态可能是图中 A G 点中的______点。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的 H2 可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如下图所示。若导电基体上的 Pt 颗粒增多,造成的后果是______。
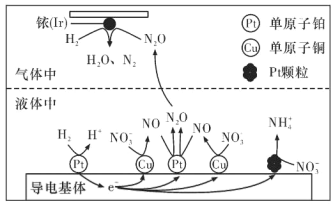
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=![]() (ΔH1 +ΔH2-3ΔH3)
(ΔH1 +ΔH2-3ΔH3)
B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1-ΔH2+3ΔH3)
(ΔH1-ΔH2+3ΔH3)
D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com