
分析 ①由质量守恒定律可知,反应前后原子个数不变;
②同周期自左而右电负性增大,金属性越强电负性越小,据此解答;
③由原子守恒可知,物质A为K2S,属于离子晶体;含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
④CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键.
解答 解:①由化学方程式为2KNO3+3C+S$\frac{\underline{\;点燃\;}}{\;}$A+N2↑+3CO2↑,根据质量守恒定律可知,反应前后元素种类、原子个数相等,N、O、C的原子个数前后相等,而反应物中有S、K元素,生成物中应一定有S、K元素,则X中含有S、K元素,反应前共1个S原子,共2个K原子,则Y中共1个S原子,共2个K原子,又X的化学计量数为1,则A的化学式为K2S,故答案为:K2S;
②同周期自左而右电负性增大,金属性越强电负性越小,故电负性O>N>C>K,
故答案为:O>N>C>K;
③由原子守恒可知,物质A为K2S,属于离子晶体,故答案为:离子晶体;
④CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,故答案为:1:1.
点评 本题考查了电负性、晶体类型、等电子体等知识,题目难度不大,注意对基础知识的理解掌握,注意④CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为易错点.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
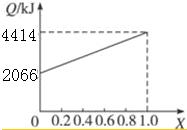
| 物质 | A | B | CO | H2 |
| 燃烧热/kJ•mol-1 | 725 | 5 518 | 283 | 286 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高效催化剂,可提高CO2的利用率 | |
| B. | 单位时间内消耗CO2和H2的物质的量比为1:3时,反应达到平衡 | |
| C. | 及时分离出CH3OH和H2O可提高CO2和H2的利用率 | |
| D. | 升高温度可使该反应向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

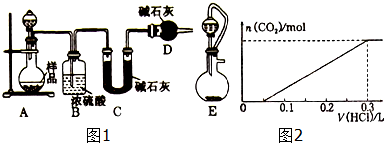
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子的价电子排布图: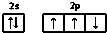 | |
| B. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| C. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| D. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族与第ⅦA族元素形成的化合物 | B. | 溶于水中能导电的化合物 | ||
| C. | 在熔化状态下能导电的化合物 | D. | 熔点高的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com