
����Ŀ������ÿһ�����е���ĸ����һ�ַ�Ӧ��������
����A��B��Ӧ��������E��F��G������C��D��Ӧ��������I������B��һ�ֻ���ɫ���壬C��һ�ֿ�ȼ�����壬D�����ǿ�������Ҫ�ɷ�֮һ��I��ˮ��Һ�Լ��ԣ�����д���пհף�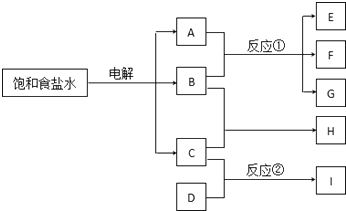
��1������H�Ļ�ѧʽ�� ��
��2��д����ⱥ��ʳ��ˮ�ķ�Ӧ����ʽ��
��3���ֱ�д���������в���B��C����ĵ缫��Ӧʽ����
��4����Ӧ�ٵĻ�ѧ����ʽ�� ��
��5����Ӧ�ڵĻ�ѧ����ʽ��Ӧע����Ӧ�������� ��
���𰸡�
��1��HCl
��2��2NaCl+2H2O�T2NaOH+H2��+Cl2��
��3��2Cl����2e��=Cl2����2H++2e��=H2��
��4��Cl2+2NaOH=NaClO+NaCl+H2O
��5��N2+3H2 ![]() 2NH3
2NH3
���������⣺��ⱥ��ʳ��ˮ����Cl2��H2��NaOH��B��һ�ֻ���ɫ���壬C��һ�ֿ�ȼ�����壬�ɿ�ͼ��֪AΪNaOH��BΪCl2 �� CΪH2 �� ������������Ӧ����HΪHCl��D�����ǿ�������Ҫ�ɷ�֮һ��I��ˮ��Һ�Լ��ԣ���IӦΪNH3 �� DΪN2 �� ��1��BΪCl2 �� CΪH2 �� ���߷�Ӧ����HCl�����Դ��ǣ�HCl����2����ⱥ��ʳ��ˮ�ķ�Ӧ����ʽΪ2NaCl+2H2O�T2NaOH+H2��+Cl2�������Դ��ǣ�2NaCl+2H2O�T2NaOH+H2��+Cl2������3���������У����������������缫��ӦʽΪ2Cl����2e��=Cl2�������������������缫��ӦʽΪ 2H++2e��=H2�������Դ��ǣ�2Cl����2e��=Cl2���� 2H++2e��=H2������4��Cl2��NaOH��Ӧ����NaClO��NaCl��H2O�������ʣ���Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaClO+NaCl+H2O��
���Դ��ǣ�Cl2+2NaOH=NaClO+NaCl+H2O����5����Ӧ��ΪN2��H2�ڴ��������µķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪN2+3H2 ![]() 2NH3 �� ���Դ��ǣ�N2+3H2
2NH3 �� ���Դ��ǣ�N2+3H2 ![]() 2NH3 ��
2NH3 ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ����Һ�м�����Ƭ�������д������������������������ڸ���Һ��һ������������ڵ��ǣ� ��
A.Na+
B.NO ![]()
C.CO ![]()
D.HCO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����AlCl3��Һ��NaAlO2��Һ�ֱ����������գ����ò������Ҫ�ɷ��ǣ� ��
A.��ΪAl��OH��3
B.ǰ�ߵ�Al2O3�����ߵ�NaAlO2
C.��ΪAl2O3
D.ǰ�ߵ�AlCl3�����ߵ�NaAlO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧƽ���ƶ�ԭ���ڻ�T�����Ϳ�ѧ�о��о�����Ҫ��ָ�����ã���һ�����ƽ���ƶ�ԭ���Ŀ�ѧ���ǣ� ��
A.��˹
B.��������
C.�Ž��з�
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˸��õؽ����Դ���⣬����һ�����о�������ȼ�ϵ�ȼ��Ч�ʣ���һ����Ѱ������Դ�����������������ȼ��Ч�ʵ��ǣ� ��
A.ú��������Һ��
B.Һ��ȼ�ϳ���״���
C.ͨ������Ŀ���
D.��ú�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������װ��̽��ϡ�����������������ڵ糡�е����Ǩ������(��֪��Cd�Ľ�����Դ���Cu)�������£��ڴ�ֱ�IJ���ϸ���ڣ��ȷ�CdCl2��Һ����ɫ����Ȼ��С�ķ���HCl��Һ����aa'���γ������Ľ��档ͨ��ɹ۲쵽�������滺�������ƶ�������˵������ȷ����( ) 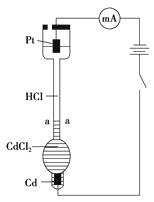
A.ͨ��ɹ۲쵽�������滺�������ƶ���ԭ����Cd2����Pt�缫Ǩ�ƵĽ��
B.װ����Pt�缫������pH����
C.һ��ʱ���ڣ����ͨ��HCl��Һijһ������ܵ���Ϊ5.0 C�����H����Ǩ�Ƶĵ���Ϊ4.1 C��˵����HCl��Һ��H����Ǩ������Լ��Cl����4.6��
D.�����Դ���������ӣ����¶˲�������Cl2 �� ʹ���治��������ʵ��ʧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����
��1��3������2��������1����ϩ�ṹ��ʽΪ ��
��2��![]() ����Ϊ ��
����Ϊ ��
��3��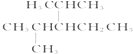 ������ ��
������ ��
��4��![]() ������ ��
������ ��
��5���л���Aֻ��C��H��O����Ԫ����ɣ��������л��ϳɵ��м��壬���8.4g���л��ᆳȼ������22.0g CO2��7.2gˮ������ͼ��������Է�������Ϊ84���������������A�к��Щ�O��H��λ�ڷ��Ӷ˵�C H���˴Ź���������ʾ��3�ַ壬�ҷ����֮��Ϊ6��1��1��
��д��A�ķ���ʽ��
��д��A�Ľṹ��ʽ��
����������һ������A������Ӧ����������ţ�
a��H2 b��Na c��KMnO4 d��Br2
���л���B��A��ͬ���칹�壬1mol B������1mol Br2�ӳɣ����л��������̼ԭ����ͬһƽ���ϣ��˴Ź���������ʾ��3�ַ壬�ҷ����֮��Ϊ6��1��1����B�Ľṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ȡ20mLijŨ�ȵ�������Ϊ����Һ����һ�����ʵ���Ũ�ȵ�NaOH��Һ���еζ�������������NaOH��Һ��Ϻ�����仯���Բ��ƣ����ζ���������Һ��pH�仯����ͼ��ʾ������������ȷ���ǣ� �� 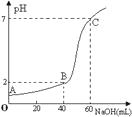
A.���������Ũ����0.09mol��L��1 �� NaOH��ҺŨ��Ϊ0.03mol��L��1
B.��B�㣬��Һ������Ũ�ȹ�ϵΪ��c(Cl��)��c(Na+)��c(OH-)��c(H+)
C.A��B��C����ˮ�ĵ���̶ȴ�С����Ϊ��A��B��C
D.�ζ�ǰ����ƿ�ô���Һ��ϴ����������Ũ��ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ����( )
��Ũ����ͨ����������ɫ�Լ�ƿ��
����������������Һ�ڿ����з����Ƿ���ʿ����ȼ�������Һ���ټ��Ȼ�����Һ������
��п��ϡ���ᷴӦ���Եõ�����
��Ũ����ε�ֽ���ϱ�ڣ�˵��Ũ���������ˮ��
����������Ͷ������������γ����꣬�����pH����5��6
A.�٢�B.�٢�C.��D.�٢ڢܢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com