
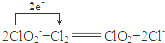 .
.
分析 (1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,消毒效率分别为$\frac{m}{67.5}$×5、$\frac{m}{71}$×2×1;
(2)①Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子;
②纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到;由配平的化学方程式可知生成24molClO2和6mol CO2气体转移24mol的电子;
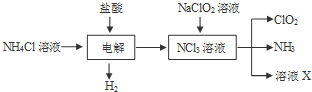
③由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl3与H2,反应方程式为NH4Cl+2HCl═3H2↑+NCl3.NaClO2和NCl3溶液混合反应生成NH3、CO2和X,结合元素化合价变化和电子守恒、原子守恒配平书写化学方程式确定X;
(3)依据m=nM计算需要的氢氧化钠溶质的质量,配制溶液需要天平称量固体质量,精确到0.1g,若实验时需要450mL 4mol/L的NaOH溶液,需要取用500ml容量瓶中配制,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还含有烧杯和500ml容量瓶,
A.称量固体时动作缓慢,可能导致氢氧化钠吸收水蒸气和空气中的二氧化碳,导致溶质减小;
B.容量瓶未干燥立即用来配制溶液对配制溶液的结果无影响;
C.NaOH固体溶解后溶液温度升高,立刻转移溶液温度升高,常温下溶液浓度增大;
D.在容量瓶中定容时俯视容量瓶刻度线,液面倍提高,定容未达到刻度;
E.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,溶液浓度减小;
解答 解:(1)以单位质量的氧化剂所得到的电子数来表示消毒效率,设质量均为m,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率分别为$\frac{m}{67.5}$×5、$\frac{m}{71}$×2×1,所以由大到小的顺序为ClO2>Cl2,
故答案为:Cl2<ClO2;
(2)①Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子方程式、电子转移的方向和数目表示为 ,
,
故答案为: ;
;
②纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
30mol的气体~24mole-
30×22.4L 24mol
1.12L 0.16mol
所以转移电子数为0.04NA,
故答案为:1;C6H12O6;24;6;12;Na2SO4,0.04NA;
③由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl3与H2,反应方程式为NH4Cl+2HCl═3H2↑+NCl3.NaClO2和NCl3溶液混合反应生成NH3、CO2和X,N元素化合价+6价变化为-3价,氯元素化合价降低1,电子转移总数为6,化学方程式为:6ClO2-+NCl3+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,所以X为NaCl和NaOH溶液,
故答案为:NaCl和NaOH溶液;
(3)实验时需要450mL 4mol/L的NaOH溶液,需要取用500ml容量瓶中配制,配制溶液需要天平称量固体质量,精确到0.1g,依据m=nM计算需要的氢氧化钠溶质的质量=0.5L×4mol/L×40g/mol=80.0g,若实验时需要450mL 4mol/L的NaOH溶液,需要取用500ml容量瓶中配制,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还含有烧杯和500ml容量瓶,
A.称量固体时动作缓慢,可能导致氢氧化钠吸收水蒸气和空气中的二氧化碳,导致溶质减小,测定结果偏低,故A错误;
B.最后配制溶液需要加入水定容,容量瓶未干燥立即用来配制溶液对配制溶液的结果无影响,故B错误;
C.NaOH固体溶解后溶液温度升高,立刻转移溶液温度升高,常温下液面未达到刻度,溶液浓度增大,故C正确;
D.在容量瓶中定容时俯视容量瓶刻度线,液面倍提高,定容未达到刻度,溶液浓度增大,故D正确;
E.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,水加入超出刻度线,溶液浓度减小,故E错误;
故选CD.
故答案为:80.0,500mL容量瓶、烧杯,CD;
点评 本题考查了氧化还原反应电子转移,电子守恒计算分析,化学方程式书写,溶液配制方法和过程分析应用,掌握基础是解题关键,题目难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 1mol•L-1 的NaCl溶液 | B. | 150mL 1mol•L-1 的MgCl2溶液 | ||
| C. | 100mL 1mol•L-1 的HCl溶液 | D. | 50mL 1mol•L-1 的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
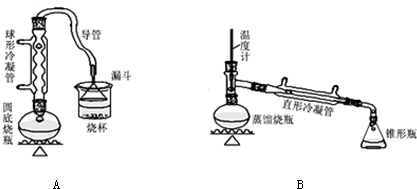
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K22=$\frac{1}{{k}_{1}}$ | B. | K1=K2 | C. | K12=K2 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com