
| A. | 向CuCl2溶液中加入铁粉 | |
| B. | 向FeO粉末中加入稀硫酸 | |
| C. | 单质Fe与过量稀盐酸反应后的溶液中再加入少量氯水 | |
| D. | Fe(OH)3与过量稀盐酸反应后的溶液中再加入过量铁粉 |
分析 A.铁和氯化铜溶液反应生成铜和氯化亚铁;
B.氧化亚铁和硫酸反应生成硫酸亚铁和水;
C.单质Fe与过量稀盐酸反应后生成氯化亚铁和氢气,溶液中再加入少量氯水氧化氯化亚铁为氯化铁;
D.Fe(OH)3与过量稀盐酸反应生成氯化铁,加入过量铁粉生成氯化亚铁.
解答 解:A.铁和氯化铜溶液反应生成铜和氯化亚铁,溶液中无铁离子,滴入KSCN溶液不显红色,故A错误;
B.氧化亚铁和硫酸反应生成硫酸亚铁和水,溶液中无铁离子,滴入KSCN溶液不显红色,故B错误;
C.单质Fe与过量稀盐酸反应后生成氯化亚铁和氢气,溶液中再加入少量氯水氧化氯化亚铁为氯化铁,滴入KSCN溶液显红色,故C正确;
D.Fe(OH)3与过量稀盐酸反应生成氯化铁,加入过量铁粉生成氯化亚铁,溶液中无铁离子,滴入KSCN溶液不显红色,故D错误;
故选C.
点评 本题考查铁的性质,为高频考点,把握发生的反应及物质的性质等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加入乙醇和浓硫酸,然后加热 | |
| B. | 碳酸钠固体(碳酸氢钠):加热至恒重 | |
| C. | FeCl2溶液(FeCl3、CuCl2):加入过量Fe粉充分搅拌,然后过滤 | |
| D. | 乙醇(水):加入新制的生石灰,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
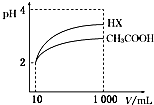 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的导电性 | B. | 金属的延展性 | ||
| C. | 地壳中金属元素的含量 | D. | 金属冶炼的难易程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:实验题
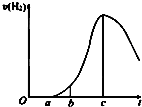 成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.
成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| M |
| A. | X、Y、Z、W形成的单质中都含有非极性共价键 | |
| B. | 元素最高价氧化物水化物对应的酸性大小W>Z,简单离子半径大小 关系:W>Z>X | |
| C. | M的氢化物的沸点高于X的,化合物M2O3有氧化性和还原性 | |
| D. | 有“海洋元素”美誉的元素与M同周期与W同主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中,硫元素被氧化 | |
| B. | 上述反应中,Y为氮气 | |
| C. | 红色固体是氧化亚铜 | |
| D. | 98g H2SO4参与反应,必转移0.5NA个电子(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com