
| A. | 加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 水电离出的c(H+)=1×10-14mol•L-1的溶液中:Ba2+、NO3-、K+、SO32- | |
| C. | 使苯酚显紫色的溶液中:NH4+、Na+、Cl-、SCN- | |
| D. | 使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3- |
分析 A.加入铝粉能产生H2的溶液可能呈酸性或碱性;
B.水电离出的c(H+)=1×10-14mol•L-1的溶液呈酸性或碱性;
C.使苯酚显紫色的溶液含有Fe3+;
D.使甲基橙变红的溶液呈酸性.
解答 解:A.加入铝粉能产生H2的溶液可能呈酸性或碱性,碱性条件下NH4+、Fe2+不能大量共存,酸性条件下Fe2+、NO3-发生氧化还原反应,故A错误;
B.水电离出的c(H+)=1×10-14mol•L-1的溶液呈酸性或碱性,Ba2+、SO32-反应生成沉淀,且酸性条件下SO32-不能大量共存,故B错误;
C.使苯酚显紫色的溶液含有Fe3+,与SCN-发生络合反应而不能大量共存,故C错误;
D.使甲基橙变红的溶液呈酸性,酸性条件下离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存,为高考常见题型和高频考点,侧重信息的抽取和离子反应的考查,注意氧化还原及络合反应为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
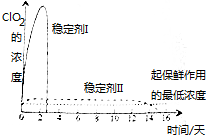 目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2与Cl2的氧化性质相近,在自来水消毒和果蔬保鲜等方面应用广泛.有关数据见下表:
目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2与Cl2的氧化性质相近,在自来水消毒和果蔬保鲜等方面应用广泛.有关数据见下表:| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 沸点/℃ | 3.8 | 11.0 | 82.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
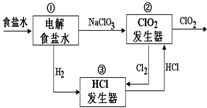 利用食盐水制取ClO2的工业流程如右图所示,
利用食盐水制取ClO2的工业流程如右图所示,| A. | 装置①中H2是阴极产物 | |
| B. | 装置②的阴极电极反应式为2ClO3-+12H++10e-=Cl2↑+6H2O | |
| C. | 该流程中Cl2、NaCl都可以循环利用 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ”的同分异构体有( )
”的同分异构体有( )| A. | 7种 | B. | 9种 | C. | 11种 | D. | 13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害 | |
| C. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放 | |
| D. | 明矾常用于水体杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol FeBr2与足量氯气反应时,理论上转移的电子数约为3×6.02×1023 | |
| B. | 常温下,pH均为3的三种溶液:①HCl溶液 ②H2SO4溶液③CH3COOH溶液,各自溶质的物质的量浓度大小顺序为①=②<③ | |
| C. | 电解熔融NaCl或AlCl3制取Na或Al | |
| D. | 一定条件下反应Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)达到平衡后,滴加少量浓硫酸,重新达平衡前,2v正(Cr2O72-)<v逆(CrO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H216O和20 g H218O含有的质子数均为10NA | |
| B. | 1L 1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -109kJ•mol-1 | B. | -218kJ•mol-1 | C. | +109kJ•mol-1 | D. | +218kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
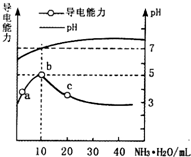 常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com