
【题目】已知SO2可以用Fe(NO3)3溶液吸收,某学习小组按如图装置展开探究:
取一定量的铜片于三颈烧瓶中,通入一段时间N2后再加入足量的浓硫酸,加热;装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀。
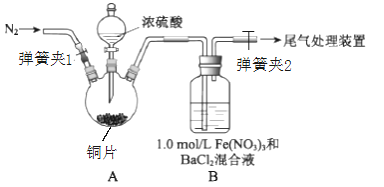
回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为_______;检查图中连通装置A、B气密性的方法是___。
(2)加入浓硫酸之前先通入N2一段时间,其目的是___________;排除装置A中白雾影响,可在装置A、B间增加洗气瓶C,则C中盛放的试剂是____________;若用NaOH溶液处理尾气,则发生反应的离子方程式为______________。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列假设(不考虑各因素的叠加):
假设1:装置A中白雾进入装置B中参与了反应
假设2:______________
假设3:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化SO2
(4)请你设计实验验证上述假设3,写出实验步骤、预期现象和结论。
实验步骤(简述操作过程) | 预期现象和结论 |
①测1.0 mol·L-1 Fe(NO3)3溶液的pH ② ____________________ ③ ____________________ ④ ___________________ | ____________________ |
【答案】分液漏斗关闭弹簧夹1和弹簧夹2,打开分液漏斗上方塞子及下方活塞,向三颈烧瓶中加水至水不再流下,分液漏斗中有水且一段时间内液面不下降,则气密性良好,否则不好排出空气饱和NaHSO3溶液SO2+2OH-=SO32-+H2OSO2被Fe3+氧化为SO42-取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中向试管中滴加少许稀硝酸,调节pH与①相同向试管中通入适量SO2气体若有白色沉淀生成,则假设3成立;反之,假设3不成立
【解析】
(1)由图可知,装置A中用于添加浓硫酸的仪器是分液漏斗;检查图中连通装置A、B气密性的方法是关闭弹簧夹1和弹簧夹2,打开分液漏斗活塞,向漏斗中加水至水不流下,停止加水,观察一段时间液面不下降,则气密性好,否则不好。
(2)加入浓硫酸之前先通入N2一段时间,其目的是排除空气的干扰;为排除硫酸酸雾的干扰,增加的洗气瓶C中盛放的溶液需将硫酸吸收但不会吸收SO2,故C中应盛放饱和NaHSO3溶液;SO2与NaOH溶液发生反应的离子方程式为SO2+2OH-=SO32-+H2O。
(3)装置B中生成的白色沉淀为BaSO4,所以溶液中生成了SO42-,结合假设1和假设3以及不考虑各因素的叠加,可推知假设2为SO2被Fe3+氧化为SO42-,与溶液中的Ba2+结合生成BaSO4。
(4)选用溶液显中性的Ba(NO3)2溶液,调节pH至酸性,再通入SO2即可验证假设3是否成立,具体过程为①取与Fe(NO3)3溶液中c(NO3-)相同的适量Ba(NO3)2溶液滴入试管中; ②向试管中滴加少许稀硝酸,调节pH与①相同;③向试管中通入适量SO2气体;结论若有白色沉淀生成,则假设3成立;反之,假设3不成立。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物X.Y的叙述正确的是
A. X分子中所有原子一定在同一平面上
B. 1molY与足量氢氧化钠溶液共热最多可消耗8molNaOH
C. X、Y均能使Br2的四氧化碳溶液褪色
D. X→Y的反应为加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1) A中官能团的名称是______________________。
(2) D→E的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4)与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为_____。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
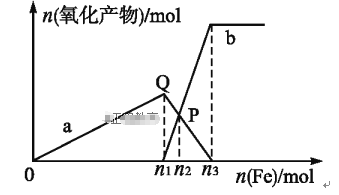
A. 曲线a表示Fe2+,曲线b表示Fe3+
B. P点时总反应的离子方程式可表示为5Fe+16H++NO3-![]() 3Fe2++2Fe3++4NO↑+8H2O
3Fe2++2Fe3++4NO↑+8H2O
C. n2=0.25
D. n3∶n1=3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是
A.正反应活化能小于100 kJ·mol-1B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能大于100 kJ·mol-1D.正反应活化能比逆反应活化能小100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)
(1)X、Y均为金属时,此反应在工业上称为___反应,其反应方程式为________
(2)X为金属,Y为非金属时,A为__B__
(3)X为非金属Y为金属时,A为__B为_______
(4)X为非金属,Y为非金属时,A为_____B为______
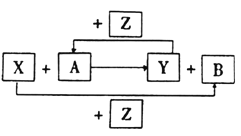
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,5.6LO2含有4NA个电子
B. 28gN2、CO和C2H4的混合气体分子总数为NA
C. 标准状况下,22.4L盐酸含有NA个HCl分子
D. 1molNa被完全氧化生成Na2O2,失去2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某稀硫酸和稀硝酸的混合溶液200 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。
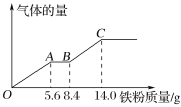
下列分析或结果正确的是( )
A. 原混合溶液中NO3 -的物质的量为0.3 mol
B. OA段产生的是NO
C. BC段产生NO
D. 原混合溶液中H2SO4的浓度为1.25 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com