
| A. | 使 SO3 的浓度增大 | B. | 使平衡向正反应方向移动 | ||
| C. | 使平衡常数 K 增大 | D. | 使正反应速率大于逆反应速率 |
分析 A.缩小容器容积,体现压强增大,平衡向气体体积减小的方向移动,根据平衡移动方向确定三氧化硫浓度变化;
B.缩小容器容积,体现压强增大,平衡向气体体积减小的方向移动;
C.化学平衡常数只与温度有关;
D.化学平衡向减弱相对反应速率大的方向移动.
解答 解:A.缩小容器容积,体现压强增大,平衡向气体体积减小的方向移动,平衡向正反应方向移动,则生成物三氧化硫浓度增大,故A正确;
B.缩小容器容积,体现压强增大,平衡向气体体积减小的方向移动,所以平衡向正反应方向移动,故B正确;
C.该反应体系温度不变,则化学平衡常数不变,化学平衡常数只与温度有关,故C错误;
D.化学平衡向减弱相对反应速率大的方向移动,缩小容器容积,压强增大,平衡向气体体积缩小的方向移动,则正反应速率大于逆反应速率,故D正确;
故选C.
点评 本题考查了压强对化学平衡的影响,注意压强只对反应前后气体体积改变的可逆反应平衡有影响,且化学平衡常数只与温度有关,与压强、浓度无关,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
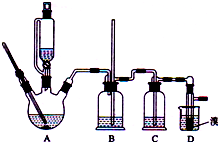 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,充入NO2气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3溶液在空气中加热蒸干并灼烧后,可以得到Fe2(SO4)3 | |
| B. | 为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下,加入氨水,过滤后向滤液中再加入适量盐酸 | |
| C. | 配制FeSO4溶液时,为了抑制亚铁离子水解,需加入少量Fe | |
| D. | 室温下,向PH=4的醋酸溶液中加入等体积的PH=10的NaOH溶液,反应后溶液呈碱性,是因为生成了强碱弱酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
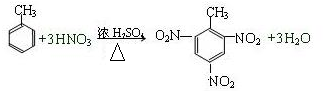

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 为了防止龋齿,人人都要使用含氟牙膏 | |
| C. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| D. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com