
| A、500mL 1mol?L-1 MgCl2溶液中含有Cl-数目为0.5NA |
| B、标准状况下,1mol H2O与1mol O2所占的体积相等 |
| C、17g NH3含有的电子个数为10NA |
| D、36g H2O与32g CH4所含的氢原子数相等 |


科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
| B、H2N(CH2)5COOH |
| C、HO(CH2)5COOH和HO(CH2)5NH2 |
| D、HOOC(CH2)4COOH和H2N(CH2)5NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B、若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流阴极保护法 |
| C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D、若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 +HNO3 +HNO3
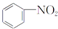 +H2O +H2O | |||
B、CH2═CH2+H2O
| |||
C、(C6H10O5)n+6nO2
| |||
D、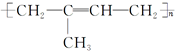 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
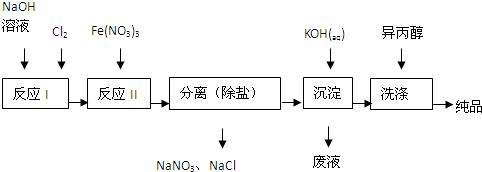
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com