
【题目】下列实验现象描述不正确的是
选项 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
C | 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中 | 镁条继续燃烧,发出耀眼白光放出大量热量,生成白色固体 |
D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
【答案】D
【解析】试题分析:加热放在坩埚中的小块钠,发生反应:2Na+O2![]() Na2O2,由于钠的熔点低,因此钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体,正确;B. 在酒精灯上加热铝箔,发生反应:4Al+3O2
Na2O2,由于钠的熔点低,因此钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体,正确;B. 在酒精灯上加热铝箔,发生反应:4Al+3O2![]() 2Al2O3,Al的熔点低只有660℃,而Al2O3熔点高达2050℃,因此铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着,正确;C. 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中,会发生反应:2Mg+ O2
2Al2O3,Al的熔点低只有660℃,而Al2O3熔点高达2050℃,因此铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着,正确;C. 点燃的镁条伸入盛有O2的集气瓶(底部铺有少量细沙)中,会发生反应:2Mg+ O2![]() 2MgO,会看到镁条继续燃烧,发出耀眼白光放出大量热量,生成白色固体MgO,正确;D. 在空气中久置的铝条放入NaOH溶液中,首先发生反应:Al2O3+2NaOH=2NaAlO2+2H2O,因此开始无气泡,后来发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。看到产生气泡,铝条逐渐变细,铝条逐渐发热,错误。
2MgO,会看到镁条继续燃烧,发出耀眼白光放出大量热量,生成白色固体MgO,正确;D. 在空气中久置的铝条放入NaOH溶液中,首先发生反应:Al2O3+2NaOH=2NaAlO2+2H2O,因此开始无气泡,后来发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。看到产生气泡,铝条逐渐变细,铝条逐渐发热,错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将22.4g铜和三氧化二铁的混合粉末加入到溶液为1mol/L的硫酸中,使之发生反应.
(1)若固体恰好全部溶解,消耗硫酸的体积为VL,则V的取值范围为 .
(2)若硫酸溶液过量,反应后的溶液体积为1L,测得此溶液中Fe2+浓度为0.1mol/L,则原混合物中含铜g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2.3g 乙醇含有个H原子,所含共价键的物质的量 , 其中所含官能团羟基的电子数为 .
(2)某条件下,8g氧气所占的体积为6L,则在该条件下的气体摩尔体积为 .
(3)100mL硫酸铝溶液中C(Al3+)=0.20mol/L(不考虑水解因素),则其中n(SO42﹣)= .
(4)在9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 此氯化物的摩尔质量为 .
(5)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为 g,转移的电子数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中正确的是
A. 铯的密度比水小,像钠一样浮在水面上
B. 铯与水反应十分剧烈,甚至会发生爆炸
C. 碳酸铯加热时易分解成二氧化碳和氧化铯
D. 氢氧化铯是强碱,其碱性比氢氧化钾弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2.3g 乙醇含有个H原子,所含共价键的物质的量 , 其中所含官能团羟基的电子数为 .
(2)某条件下,8g氧气所占的体积为6L,则在该条件下的气体摩尔体积为 .
(3)100mL硫酸铝溶液中C(Al3+)=0.20mol/L(不考虑水解因素),则其中n(SO42﹣)= .
(4)在9.5g某二价金属的氯化物中含有0.2mol Cl﹣ , 此氯化物的摩尔质量为 .
(5)6.72L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为 g,转移的电子数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题.
(1)工业制硫酸过程中,SO2催化氧化的原理为: 2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.
①a、b两点对应的平衡常数K(a)K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)c(b).
②c点时,反应速率v(正)v(逆) .
(2)电化学法处理SO2 . 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为 .
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为L(已知:1个e﹣所带电量为1.6×10﹣19C).
(3)溶液法处理SO2 . 已知常温下H2SO3和H2CO3的电离常数如表所示:
电离常数 | K1 | K2 |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
常温下,将SO2缓慢通入100mL 0.2molL﹣1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图1所示.已知 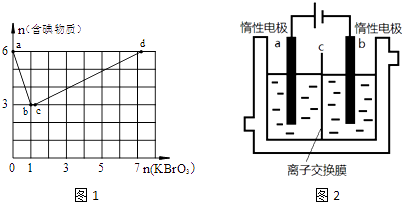
①BrO3﹣+6I一+6H+=3I2+Br﹣+3H2O;
②2BrO3﹣+I2=2IO3﹣+Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 , 还原产物是 .
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 .
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 .
(4)含6mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 .
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图2所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.阳极的电极反应式为;阴极观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com