
| A. | 16g由O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 2.3g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA | |
| C. | 100mL 12mol/L浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA | |
| D. | 0.3molAgNO3受热完全分解(2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑ ),用排水收集到气体的分子数为0.25NA |
分析 A、氧气和臭氧的摩尔质量不同;
B、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
C、二氧化锰只能与浓盐酸反应,与稀盐酸不反应;
D、将生成的气体NO2和O2通入水中后发生反应:4NO2+O2+2H2O=4HNO3;
解答 解:A、氧气和臭氧的摩尔质量不同,故16g混合物的物质的量不是定值,则含有的分子数不是定值,随着氧气和臭氧的比例不同而不同,故A错误;
B、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠转移0.1NA个电子,故B正确;
C、二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故浓盐酸变稀后反应即停止,浓盐酸不能反应完全,则生成的氯气分子个数小于0.3NA个,故C错误;
D、将生成的气体NO2和O2通入水中后发生反应:4NO2+O2+2H2O=4HNO3,由于0.3molAgNO3受热完全分解生成的气体中NO2和O2的物质的量分别为0.3mol和0.15mol,用排水法收集后,氧气消耗0.075mol,则剩余0.15mol-0.075mol=0.075mol,故收集到的分子数为0.075NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| B. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| C. | 加入水时,平衡向逆反应方向移动 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 石蕊试液 | ||
| C. | 含酚酞的氢氧化钠溶液 | D. | 淀粉碘化钾试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液PH关系为:PH(Na2S)>PH(NaCN)>PH(CH3COONa) | |
| B. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅与氮的原子数之比为4:3 | |
| B. | 氮原子与硅原子间以共价键相结合 | |
| C. | 熔点高,硬度大,可用于制造柴油机 | |
| D. | amol氮化硅含有质子数的物质的量为70amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al>Mg>Na>H | B. | 热稳定性:NH3>PH3>H2S>HCl | ||
| C. | 酸性:HClO4>H2SiO3>H3PO4>H2CO3 | D. | 元素非金属性:F>O>N>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
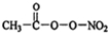 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com