
| ���� | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11��6 | 9��7 | 10��3 | 5��2 |
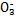 )>c(S
)>c(S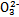 )>c(OH-)
)>c(OH-) HCl��HClO����������HCl> H2CO3> HClO�����Իᷢ����ӦNaHCO3+HCl=NaCl+H2O+ CO2����ʹCl2��H2O
HCl��HClO����������HCl> H2CO3> HClO�����Իᷢ����ӦNaHCO3+HCl=NaCl+H2O+ CO2����ʹCl2��H2O HCl��HClO�����ƶ���c(HClO)������ȷ��B����������Һ��,����Na2CO3��pH�������ˮ�ĵ���̶�������Na2CO3������C��������,��ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��Һ,����̶�������H2SO3����ĵ���̶�Խ��c(H+)Խ����Һ��pHԽС������pH������HClO��Һ������D����NaHSO3��Һ�У����ڵ��룺NaHSO3=Na++ HSO3-������ƽ�⣺HSO3-
HCl��HClO�����ƶ���c(HClO)������ȷ��B����������Һ��,����Na2CO3��pH�������ˮ�ĵ���̶�������Na2CO3������C��������,��ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��Һ,����̶�������H2SO3����ĵ���̶�Խ��c(H+)Խ����Һ��pHԽС������pH������HClO��Һ������D����NaHSO3��Һ�У����ڵ��룺NaHSO3=Na++ HSO3-������ƽ�⣺HSO3- H++ SO32-��ˮ��ƽ�⣺HSO3-��H2O
H++ SO32-��ˮ��ƽ�⣺HSO3-��H2O OH-+ H2SO3��������NaHSO3��Һ�У�pH=5��2��˵��HSO3-�ĵ������ô���ˮ�����á������εĵ������ô���������ʵĵ������ã������ڴ���Һ�и�������Ũ�ȴ�С˳��Ϊc(Na+)> c(HSO3-)> c(H+)>c(SO32-)>c(OH-)������
OH-+ H2SO3��������NaHSO3��Һ�У�pH=5��2��˵��HSO3-�ĵ������ô���ˮ�����á������εĵ������ô���������ʵĵ������ã������ڴ���Һ�и�������Ũ�ȴ�С˳��Ϊc(Na+)> c(HSO3-)> c(H+)>c(SO32-)>c(OH-)������


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ϊ�Ͻ��ڳ�ʪ�Ŀ��������γ�ԭ��أ����ԺϽ���ʴ�Զ��ϲ� |
| B���ϳɰ��ķ�Ӧ�Ƿ��ȷ�Ӧ������õ�������������߰����������� |
| C��������2S2O(g)=3S(s)+SO2(g)���Է����У����ƶϸ÷�ӦΪ���ȷ�Ӧ |
| D��NH4Cl��HCl����ˮ��μ�ʯ�ﶼ���ɫ��˵�����Ǿ��ܵ����H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������NaOH���壬�����Ӻ�̼�������Ũ�Ⱦ����� |
B��������Һ��ˮϡ�ͣ� �ı�ֵ���ֲ��� �ı�ֵ���ֲ��� |
| C��c(Na��)��c(H��)��c(HCO3��)��c(CO32��)��c(OH��) |
| D��c(Na��)��c(HCO3��)��2c(CO32��)��c(H2CO3) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ʵ���Ũ�ȵ�HA��Һ��MOH��Һ�������ϣ�c(H��)��c(M��)��c(OH��)��c(A��) |
| B��pH��ȵ�CH3COONa��NaOH��Na2CO3������Һ��c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| C�����ʵ���Ũ����ȵ�CH3COOH��CH3COONa��Һ�������ϣ� c(CH3COO��)��2c(OH��)��2c(H��)��c(CH3COOH) |
D��0.1 mol��L��1��NaHCO3��Һ��c(Na��)>c(OH��)>c(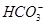 )>c(H��) )>c(H��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a��bʱ��c(OH��)��c(H��)��c(HS��) |
| B��a��2bʱ��c(S2��)>c(HS��)>c(OH��)>c(H��) |
| C��a��3bʱ��c(Na��)��c(H��)��2c(S2��)��c(HS��)��c(OH��) |
| D��a��4bʱ��4c(Na��)��5c(S2��)��5c(HS��)��5c(H2S) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(Na+)��c(S2-)��c(OH-)��c(HS-�� | B��c(Na+)+c(H+)��c(HS-)+2c(S2-)+c(OH-) |
| C��c(Na+)��2c(HS-)+2c(S2-)+2c(H2S�� | D��c(OH-)��c(H+��+ c(HS-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ǿ��:HCN>HClO |
| B��pH:HClO>HCN |
| C����NaOHǡ����ȫ��Ӧʱ,����NaOH�����ʵ���:HClO>HCN |
| D���������Ũ��:c(CN-)<c(ClO-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH��ȵĢ�NH4Cl����(NH4)2SO4����NH4HSO4����Һ�У�c(NH4+)��С���٣��ڣ��� |
| B�������£���10 mL pH��12������������Һ�м���pH��2��HA��pH�պõ���7��������Һ���V(��)��20 mL |
| C����1.00 L 0.3 mol��L��1��NaOH��Һ�л���ͨ��CO2��������Һ����8.8 g��������Һ�У�3c(Na��)��2[c(HCO3��)��c(CO32��)��c(H2CO3)] |
| D��Ũ�Ⱦ�Ϊ0.1 mol��L��1��CH3COOH��CH3COONa��Һ�������ϣ�c(CH3COO��)��c(CH3COOH)��c(H��)��c(OH��) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com