
【题目】由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O))的流程如图:
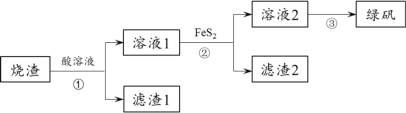
已知:①FeS2(S的化合价为-1)难溶于水。②FeS2+7Fe2(SO4)3+8H2O =15FeSO4+8H2SO4
(1)①中加入的酸为________,滤渣2的主要成分是 __________。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、___________。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,________。
(4)通过③得到绿矾晶体的实验操作:____________、过滤、洗涤、干燥。
【答案】硫酸(H2SO4) FeS2 Fe2O3+6H+=2Fe3++3H2O 向其中滴加KSCN溶液,溶液不变红 过滤、洗涤、干燥
【解析】
烧渣(主要成分:Fe3O4、Fe2O3和FeO)均溶于硫酸,溶液1含Fe2+、Fe3+,步骤②发生FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,步骤③为蒸发浓缩、冷却结晶析出绿矾,以此解答该题。
(1)因绿矾的酸根离子为硫酸根离子,则步骤①,应用硫酸来溶解烧渣;步骤②发生FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,因为FeS2难溶于水,所以滤渣2的主要成分是FeS2,故答案为:硫酸(H2SO4);FeS2;
(2)①中生成Fe3+的物质有Fe3O4、Fe2O3,则另一个离子反应为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(3)可向其中加入KSCN溶液,溶液不变红,则可说明②中Fe3+已经完全转化为Fe2+,故答案为:向其中滴加KSCN溶液,溶液不变红;
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:过滤、洗涤、干燥。


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。

(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是__。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:__。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg。量气瓶中收集到VmL气体,则有:![]() ,依据的原理是___。
,依据的原理是___。
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,![]() =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,![]() 的数值将__(填偏大、偏小或无影响)。
的数值将__(填偏大、偏小或无影响)。
(5)反应结束后,为了准确地测量气体体积,除了待冷却至室温才开始读数外,量气管在读数时还应注意:①___;②___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示![]() ,则苯氯乙酮不可能具有的化学性质是___(填字母序号)。
,则苯氯乙酮不可能具有的化学性质是___(填字母序号)。
a.加成反应 b.取代反应 C.消去反应d.水解反应 e.银镜反应 f.还原反应
(2)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
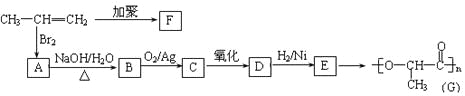
①聚合物F的结构简式:_________________________________________。
②c与新制的Cu(OH)2碱性悬浊液共热转化为D的化学方程式是:________________。
③在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年5月1日上海世博会隆重开幕,受到全世界人们的关注。世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料。聚碳酸酯的结构简式如图所示,下列说法正确的是( )
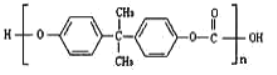
A.它是由一种单体聚合而成的B.它是通过加聚反应得到的产物
C.它是一种纯净物D.它不耐强碱,可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法不正确的是( )
A.![]() 的分子式为C4H6O
的分子式为C4H6O
B.A的结构简式是CH2=CHCH=CH2
C.B存在顺反异构现象
D.②、③的反应类型分别为水解反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质检验、分离、提纯和制备是化学实验中的常见操作。
(1)除去FeCl3溶液中混有的FeCl2可采取的方法是______(用离子方程式表示)。
(2)检验食盐中所含阳离子的实验操作名称是_________。
(3)检验Fe2(SO4)3溶液中是否含有FeSO4所用试剂是_________。
(4)实验室制备氯气的化学反应方程式为_______,请在方程式中标出电子转移的方向和数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
物质 | X | Y | Z |
初始浓度(mol/L) | 0.1 | 0.2 | 0 |
2min末浓度(mol/L) | 0.08 | a | b |
平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t℃时,2min末Y与Z的物质的量浓度:a=0.06mol/L,b=0.4mol/L
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com