
(4分)浓硫酸在下列用途和现象中所表现的性质是
A.沸点高、难挥发 B.酸性 C.吸水性 D.脱水性 E.强氧化性
|
用途或现象 |
体现浓硫酸的性质 |
|
(1)浓硫酸使胆矾变成白色 |
|
|
(2)浓硫酸使蔗糖变”黑面包” |
|
|
(3)浓硫酸与铜片共热 |
|
|
(4)浓硫酸的木炭共热产生气体 |
|
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
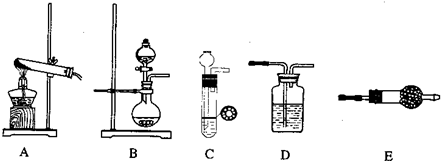
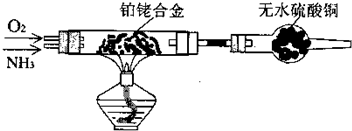
| 制备NH3 | 干燥 | 化学方程式 | ||
| 仪器 | 药品 | 仪器 | 药品 | |
查看答案和解析>>
科目:高中化学 来源:重难点手册 高中化学·必修1 配人教版新课标 人教版新课标 题型:022
铁是自然界中分布最广的金属元素之一,在地壳中其质量约占5%左右,铁矿石的种类很多,重要的有磁铁矿石(主要成分为Fe3O4)、赤铁矿石(主要成分为Fe2O3)、菱铁矿石(主要成分为FeCO3)等.在实验室中,用甲酸和浓硫酸反应制取的CO还原赤铁矿石得到铁.制取CO的化学反应为:HCOOH![]() CO↑+H2O.回答下列问题:
CO↑+H2O.回答下列问题:
(1)写出以赤铁矿石为原料制取铁的主要化学方程式:________.
(2)具支试管(试管侧壁有一支管,如图所示)在实验室有多种用途.现只用具支试管、橡皮塞(橡皮塞上最多只能打一个孔)、玻璃导管及连接和夹持仪器,用浓硫酸和甲酸的混合液制取CO气体,用CO还原氧化铁,并检验其氧化产物.请画出该装置的示意图(要求实验装置具有环保特点,同种仪器最多只能用三次,不必画夹持仪器,但需注明所装的药品).
(3)红热铁粉在冷却过程中,应防止其直接和水接触,否则可能引起爆炸,这是因为红热的铁粉和水反应生成了一种可燃性气体,其反应化学方程式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅱ.实验室制备氨气,下列方法适宜选用的是______________。?
①加热分解固态氯化铵 ②向固体氢氧化钠中滴加浓氨水 ③氯化铵溶液与氢氧化钠溶液共热?④固态氯化铵与氢氧化钙混合加热?
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。?

[实验操作]?
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气产生。在F出口处收集氢气并检验其纯度。?
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。?
完成下列问题:?
(1)检验氢气纯度的目的是______________。?
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是______________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是________________________________________,C瓶内气体的成分是______________。?
(3)在步骤③中,先加热铁触媒的原因是____________________________。反应管E中发生反应的化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2+![]() +4H+====Mn2++2CO2↑+2H2O
+4H+====Mn2++2CO2↑+2H2O
2![]() +5
+5![]() +16H+====2Mn2++10CO2↑+8H2O
+16H+====2Mn2++10CO2↑+8H2O
通过如下实验测定软锰矿中MnO2的质量分数。
①准确称取软锰矿样品m g于烧杯中,加入过量草酸钠(Na2C2O4)和足量的稀硫酸,加热至反应完全(杂质不参加反应);
②冷却、过滤、洗涤,洗涤液及滤液全部转移至500 mL容量瓶并定容;
③从容量瓶中取出25.00 mL溶液于锥形瓶中,以0.0200 mol·L-1的KMnO4标准溶液滴定,当滴入20.00 mL KMnO4溶液时达滴定终点。
请回答下列问题:
(1)实验步骤①中草酸钠必须加入过量的目的是__________________________________。
(2)实验步骤②中若未将洗涤液(含洗涤滤出物、盛滤液的烧杯及玻棒)全部转移入容量瓶,将导致测量结果____________。(填“偏高”“偏低”或“无影响”)
(3)实验步骤③中KMnO4标准溶液应置于____________(填“酸式”或“碱式”)滴定管中。判断达到滴定终点的现象是__________________________________________。
(4)欲实现本实验的目的,实验中还应准确获得的数据是____________。请用设定的物理量结合测定的数据表示出该软锰矿中MnO2的质量分数:____________。
(5)完成本实验的化学原理有多种。例如:
①4MnO2![]() 2Mn2O3+O2↑;
2Mn2O3+O2↑;
②3MnO2+4Al![]() 3Mn+2Al2O3;
3Mn+2Al2O3;
③MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
试从化学实验方案设计的科学性、简约性等评估,上述原理中适宜的是__________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.合成氨工业对化学和国防工业具有重要意义。写出氨的两种重要用途_________________________________。
Ⅱ.实验室制备氨气,下列方法中适宜选用的是__________________。
①固态氯化铵加热分解
②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热
④固态氯化铵与氧化钙混合加热
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图119中夹持装置均已略去)。

图1-9
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气产生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
完成下列问题:
(1)检验氢气纯度的目的是___________________________。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是__________________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是___________________________,C瓶内气体的成分是_________。
(3)在步骤③中,先加热铁触媒的原因是____________________________________。反应管E中发生反应的化学方程式是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com