
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
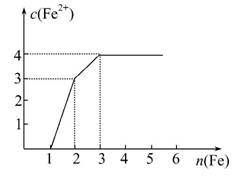
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
选D。由于先发生反应:Fe+4HNO3====Fe(NO3)3+NO↑+2H2O,再发生反应:Fe+2Fe(NO3)3====3Fe(NO3)2,最后发生反应:Fe+Cu(NO3)2====Fe(NO3)2+Cu。由图像知,1 mol Fe与HNO3发生反应,生成Fe(NO3)31 mol,需HNO34 mol;由图像知,
1 mol Fe与Fe(NO3)3发生反应,则需Fe(NO3)32 mol,所以原溶液中含有Fe(NO3)3
1 mol;由图像知,1 mol Fe与Cu(NO3)2发生反应,则需Cu(NO3)21 mol,所以原溶液中含有Cu(NO3)21 mol,故选D项。
【方法技巧】铁与硝酸的反应规律
(1)铁与浓硝酸在常温下钝化,在加热时剧烈反应。
(2)铁与稀硝酸的反应:
硝酸过量时:
Fe+4HNO3====Fe(NO3)3+NO↑+2H2O ①
Fe过量时:
3Fe+8HNO3====3Fe(NO3)2+2NO↑+4H2O ②
铁与稀硝酸反应有关量的问题,可用数轴表示为:
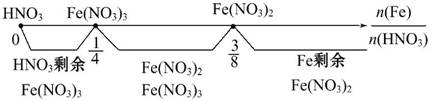
①当 时,按反应①进行,
时,按反应①进行,
产物仅有Fe(NO3)3,HNO3可能有剩余。
②当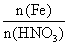 ≥
≥ 时,按反应②进行,
时,按反应②进行,
产物仅有Fe(NO3)2,Fe可能有剩余。
③当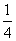 <
<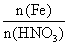 <
< 时,则反应①②均发生,
时,则反应①②均发生,
产物为Fe(NO3)2和Fe(NO3)3。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置.写出A中发生反应的化学方程式:________________________________.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:______________________
____________________________________________________________________.
(4)试管F中收集满气体后,下一步实验操作是:____________________________________
________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:
Na+2H2O====Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:
Al+2OH-====Al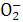 +H2↑
+H2↑
C.金属铝溶于盐酸中:2Al+6H+====2Al3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+====Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)请用离子方程式表示以上工艺流程中第①步反应:___________________ 。
(2)写出以上工艺流程中第③步反应的化学方程式:_______________________。
(3)金属铝与氧化铁混合点燃,会发生剧烈的反应。该反应的化学方程式为 __
________________________________________________________________。
请举一例该反应的用途______________________________________________。
(4)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )
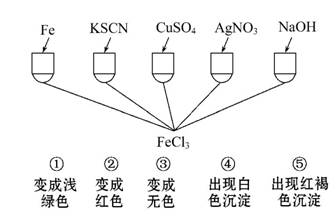
A.只有④ B.只有③
C.③和④均错 D.全部错误
查看答案和解析>>
科目:高中化学 来源: 题型:
我国科学家发明的一种可控锂水电池的工作原理如
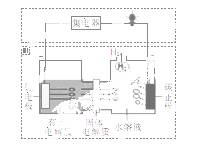 图所示。下列有关说法不正确的是
图所示。下列有关说法不正确的是
A.电池工作时,锂离子向正极移动
B.有机电解质可用水溶液代替
C.电池总反应为2Li + 2H2O====2LiOH + H2↑
D.该装置不仅可提供电能,还可得到清洁的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法:
(1)酸性条件
燃料电池总反应式:CH4+2O2===CO2+2H2O ①
燃料电池正极反应式:O2+4H++4e-===2H2O ②
①-②×2,得燃料电池负极反应式:____________________________________。
(2)碱性条件
燃料电池总反应式:CH4+2O2+2NaOH===Na2CO3+3H2O ①
燃料电池正极反应式:O2+2H2O+4e-===4OH- ②
①-②×2,得燃料电池负极反应式:______________________________________。
(3)固体电解质(高温下能传导O2-)
燃料电池总反应式:CH4+2O2===CO2+2H2O ①
燃料电池正极反应式:O2+4e-===2O2- ②
①-②×2,得燃料电池负极反应式:_____________________________________。
(4)熔融碳酸盐(如:熔融K2CO3 )环境下
)环境下
电池总反应式:CH4+2O2===CO2+2H2O ①
正极电极反应式:O2+2CO2+4e-===2CO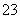 ②
②
① -②×2,得燃料电池负极反应式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,
该电池主要工作原理如右图所示,其正极反应为:ClO- + H2O + 2e- == Cl- + 2OH-,关于该电池的叙述正
确的是
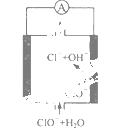 A.该电池中镁为负极,发生还原反应
A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + C lO- + H2O == Mg(OH)2↓+ Cl-
lO- + H2O == Mg(OH)2↓+ Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com