
分析 从化合价的变化的角度分子氧化剂、氧化产物等氧化还原反应的有关概念,氧化剂在反应中得电子,化合价降低,还原剂在反应中失电子,化合价升高,据此分析.
解答 解:(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价有0价升高为+2价,N元素的化合价由+5价降低为+2价,故答案为:铜;氮;
(2)氧化还原反应中,所含元素化合价降低的物质被还原,为氧化剂,所含元素化合价升高的元素为还原剂,被氧化,为氧化反应,对应的产物为氧化产物,该反应中,HNO3是氧化剂,Cu(NO3)2是氧化产物,故答案为:HNO3;氧化;Cu(NO3)2;
(3)氧化还原反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中失电子的元素是铜元素,化合价升高,得电子的元素是氮元素,化合价降低,转移的电子数目为6mol,电子转移情况为: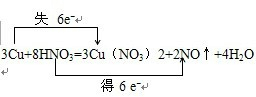 ;故答案为:
;故答案为: ;
;
点评 本题考查氧化还原反应的有关概念,题目难度不大,注意基础知识的积累.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述Ⅱ |
| A | SO2和氯水有漂白性 | 两者都能使溴水褪色 |
| B | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
| C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
| D | 用淀粉-KI溶液鉴别FeCl2 | Fe2+有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径都在1~100nm之间 | B. | 均能产生丁达尔效应 | ||
| C. | 用漏斗过滤时滤纸上没有滤渣留下 | D. | 均呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com