

科目:高中化学 来源:不详 题型:单选题
| A.pH=7的溶液不一定是中性溶液 |
| B.能自发进行的化学反应,一定是△H<0、△S>0 |
| C.自行车钢架生锈主要是电化学腐蚀所致 |
| D.Zn 具有还原性和导电性,可用作锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cd(OH)2(s) + 2 Ni(OH)2(s)
Cd(OH)2(s) + 2 Ni(OH)2(s)| A.电池工作时的负极反应是:Cd(s) - 2e-+2OH-(aq)=Cd(OH)2(s) |
| B.充电时的阳极反应是:Ni(OH)2(s) - e-+OH-(aq)=NiOOH(s)+H2O(l) |
| C.放电时每转移1mol电子,正极有1 mol NiOOH被还原 |
| D.电池工作时,负极区pH增大,正极区pH减小,但整个电池的pH基本保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.混合动力车上坡或加速时,溶液中的OH-向乙电极移动 |
| B.混合动力车刹车或下坡时,乙电极周围溶液的pH增大 |
| C.混合动力车上坡或加速时,乙电极电极反应式为 NiOOH+H2O+e-=Ni(OH)2+OH- |
| D.混合动力车刹车或下坡时,甲电极电极反应式为H2+2OH-+2e- =2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④⑤ | B.①③⑥ | C.①③④ | D.②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将铜铝导线焊接在一起使用 | B.将输送自来水的铁管表面镀锌 |
| C.经常用自来水冲洗生铁制品 | D.将输油铸铁管道埋在潮湿、疏松的土壤中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解饱和食盐水制烧碱时,Fe作阳极,石墨作阴极 |
| B.电解氯化铜时,阳极上产生的气体质量和阴极上析出的铜的质量相等 |
| C.钢铁在空气中发生电化腐蚀时,铁作负极 |
| D.原电池工作时,阳离子移向电池的负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2PbSO4+2H2O
2PbSO4+2H2O 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
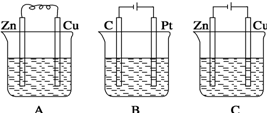
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com