
(14分)I.草酸晶体的组成可用H2C2O4·x H2O表示,为了测定x值,进行如下实验:
(1) 称取Wg草酸晶体,配成100.00 mL水溶液
(2) 取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为a mol·L—1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 = K2SO4 + 10CO2↑ + 2MnSO4 + 8H2O
试回答:
①在滴定过程中若用去a mol·L—1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为 mol·L—1,由此可计算x的值是 。
②若滴定终点读数时俯视,则计算的x值可能会 (偏大、偏小、无影响)。
Ⅱ.实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
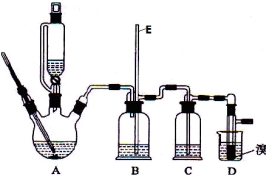
提示:乙醇与浓硫酸在140℃时脱水生成乙醚,在170℃时脱水生成乙烯。
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置D中发生主要反应的化学方程式为 。
(2)装置B的作用 ,长玻璃管E的作用 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4) 反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
(5)若产物中有少量未反应的Br2,最好用 洗涤除去 (填正确选项前的字母) 。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
答案:(14分)
I.① 0.1av,( 2分) 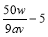 ( 2分)
( 2分)
②偏大 ( 1分)
Ⅱ.(1) CH2=CH2+Br2→CH2BrCH2Br(2分)
(2)防止倒吸(1分)、判断装置是否堵塞(1分)(合理即给分)
(3) c(1分)
(4)溴易挥发,冷水可减少挥发(1分);但如果用冰水冷却会使产品1,2-二溴乙烷凝固而堵塞导管。(1分) 下(1分)
(5) b (1分)
【解析】
试题分析:I. ①根据2 KMnO4 + 5 H2C2O4 + 3 H2SO4 = K2SO4 + 10CO2↑ + 2MnSO4 + 8H2O得草酸的物质的量是高锰酸钾的2.5倍,所以所配草酸的物质的量浓度是V×10-3L×a mol·L—1×2.5/25×10-3L=0.1aVmol/L;100mL的草酸溶液需H2C2O4·x H2O的物质的量是0.1L×0.1aVmol/L,其质量为Wg,所以(90+18x)g/mol×0.1L×0.1aVmol/L=Wg,解得x=50W/9aV-5;
②若滴定终点读数时俯视,则所读数值偏小,消耗的高锰酸钾溶液的体积偏小,根据x=50W/9aV-5,得x值偏大;
II.(1)装置D中发生的反应是乙烯与溴的加成反应,化学方程式为CH2=CH2+Br2→CH2BrCH2Br;
(2)装置B的作用是安全瓶的作用,防止倒吸;长玻璃管E的作用是判断该反应过程中是否发生堵塞,若发生堵塞,则E中的液面上升;
(3)装置C中试剂的作用是吸收乙烯中可逆存在的酸性气体,所以应选择碱性物质,而碳酸氢钠与酸性气体反应可逆产生二氧化碳气体,所以应选择氢氧化钠溶液,答案选C;
(4)因为溴易挥发,反应过程中应用冷水冷却装置D,其主要目的是减少溴的挥发,但不能用冰水的原因是,根据表中的数据可知,1,2-二溴乙烷的熔点较低,若用冰水,则会使产品1,2-二溴乙烷凝固而堵塞导管。1,2-二溴乙烷的密度大于水的密度且不溶于水,所以将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层;
(5)A、溴在水中的溶解度不大,不能用水除溴,错误;B、产品中的溴应用氢氧化钠溶液除去,溴与氢氧化钠反应,而常温下1,2-二溴乙烷不与氢氧化钠反应且不溶于水,然后分液除去,下层即得产品,正确;C、溴与碘化钠反应生成碘单质,碘易溶于有机溶剂,错误;D、溴易溶于乙醇,乙醇也易溶于有机溶剂,所以用乙醇不能除去溴,错误,答案选C。
考点:考查滴定实验的计算域误差分析,1,2-二溴乙烷的制取实验


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届北京市高三8月开学测试化学试卷(解析版) 题型:选择题
有机物:①正戊烷 ②异戊烷 ③新戊烷 ④正丁烷 ⑤异丁烷,
它们的沸点按由高到低的顺序排列正确的是
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.①>②>④>③>⑤ D.①>②>③>⑤>④
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
【有机化学基础】(14分)
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省
略):
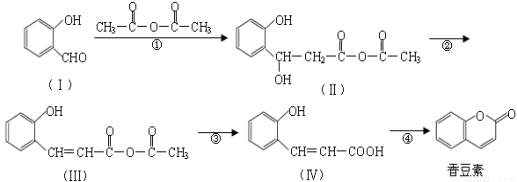
(1)Ⅰ的分子式为_____________;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为______________。
(2)反应②的反应类型是_____________,反应④的反应类型是_____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为
________ 。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能够发生酯化反应和银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下,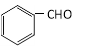 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。对于过氧化钙(CaO2)的叙述错误的是( )
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1:1
C.CaO2和水反应时,每产生1 mol O2转移电子4 mol
D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol NaHSO4晶体中离子总数为3NA
B.2.24 L 14CH4分子中所含中子数为0.8NA
C.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D.常温常压下,16gO2和O3混合气体含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;Z2-离子半径大于W-离子半径;Y是一种重要的半导体材料。下列说法中错误的是
A.元素X、M可形成既含离子键又含共价键的化合物
B.气态氢化物的稳定性:Z<W
C.Y元素在自然界中以化合物的形式存在
D.W元素的含氧酸都属于强酸
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列溶液中离子可以大量共存的是
A.常温下c(H+)/c(OH-)= 1×10-12的溶液:NH4+、Ca2+、C1-、K+
B.加Zn能放出H2的溶液:Mg2+、SO42-、Cl- 、HCO3-
C.含有较多Fe3+的溶液:Na+、H+、Cl-、SO42-
D.滴入KSCN溶液呈红色的溶液:K+、Na+、SO42-、CO32-
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)4.4金属的电化学腐蚀与防护(解析版) 题型:选择题
如下图所示装置中都盛有0.1 mol·L-1的NaCl溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是( )
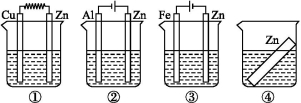
A.③①④② B.①②④③ C.①②③④ D.②①④③
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:实验题
)氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。

回答下列问题:
(1)起始滤液的pH 7(填“大于”“小于”或“等于”),其原因是 ;
(2)试剂Ⅰ的化学式为 ,①中发生反应的离子方程式为 ;
(3)试剂Ⅱ的化学式为 ,②中加入试剂Ⅱ的目的是 ;
(4)试剂Ⅲ的名称是 ,③中发生反应的离子方程式为 ;
(5)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用0.100 0 mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为 。(列式并计算结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com