
| A. | 22.4L Cl2完全溶液氢氧化钠溶液时,转移电子数为NA | |
| B. | 常温下,18g D2O中所含电子的数目为10NA | |
| C. | 标准状况下,2.24L NH3中含有的共价键数目为0.3NA | |
| D. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
分析 A、气体体积,温度压强不知不能计算物质的量;
B.物质的量n=$\frac{m}{M}$,D2O中含10个电子计算;
C、标准状况下,2.24 L NH3物质的量为0.1mol,结合氨气分子式计算共价键数;
D、常温下,22.4 L NO2和N2O4的混合气体物质的量不是1mol.
解答 解:A、气体体积,温度压强不知不能计算物质的量,故A错误;
B.物质的量n=$\frac{m}{M}$=$\frac{18g}{20g/mol}$=0.9mol,0.9molD2O中含电子数=0.9mol×10×NA=9NA,故B错误;
C、标准状况下,2.24 L NH3物质的量为0.1mol,结合氨气分子式计算共价键数=0.3NA,故C正确;
D、常温下,22.4 L NO2和N2O4的混合气体物质的量不是1mol,22.4 L NO2和N2O4的混合气体中含有氧原子不是NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的体积应用分析,氧化还原反应电子转移的计算,掌握基础是关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铝片放入氢氧化钠溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| B. | Na与水反应:Na+2H2O═Na++H2↑+2OH- | |
| C. | 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | AlCl3溶液中滴入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
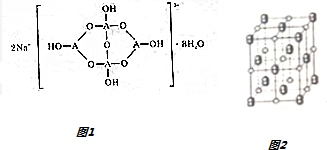

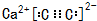 ,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)
,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将质量分数为40%(密度为1.43g•cm-3)的NaOH溶液与等体积水混合,所得溶液中溶质的质量分数是20% | |
| B. | 要配制浓度为0.25mol•L-1的NaOH溶液480mL,应称量4.8gNaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容 | |
| C. | 配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配浓度偏高 | |
| D. | 配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
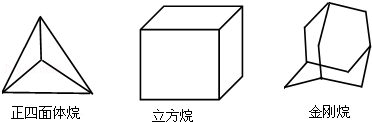
| A. | 2种 4种 8种 | B. | 2种 4种 6种 | C. | 1种 3种 6种 | D. | 1种 3种 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,B为18电子分子,其结构式为
,B为18电子分子,其结构式为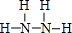 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com