
| A. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| B. | 除去NaCl中少量的KNO3,可将固体混合物制成热饱和溶液,冷却结晶、过滤 | |
| C. | 将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率 | |
| D. | 将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色沉淀 |
分析 A、测定中和热时应迅速加入碱液,防止热量散失;
B、硝酸钾的溶解度随温度变化较大,但含量少;
C、反应速率V=$\frac{△C}{△t}$;
D、将铁钉放试管中,加入2mL水、3滴稀醋酸,铁会失电子变为Fe2+;
解答 解:A、测定中和热时应迅速加入碱液,防止热量散失,缓慢加入导致测得热量减少,故A错误;
B、硝酸钾的溶解度随温度变化较大,但含量少,故将固体混合物制成热饱和溶液,冷却结晶后,少量的硝酸钾难以析出,达不到除去硝酸钾的目的,故B错误;
C、反应速率V=$\frac{△C}{△t}$,将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来大体比较反应速率的快慢,但不能计算出反应速率大小,故C错误;
D、将铁钉放试管中,加入2mL水、3滴稀醋酸,铁会失电子变为Fe2+,和滴入的K3[Fe(CN)6]溶液反应生成蓝色沉淀,故D正确.
点评 本题考查了物质的分离提纯、中和热测定的注意事项等问题,难度不大,注意基础的掌握.


科目:高中化学 来源: 题型:解答题
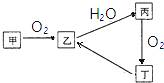 已知甲、乙、丙、丁4种物质均含有常见非金属元素,其中甲为淡黄色粉末.它们之间有如图所示的转化关系(转化过程中部分产物未标出).
已知甲、乙、丙、丁4种物质均含有常见非金属元素,其中甲为淡黄色粉末.它们之间有如图所示的转化关系(转化过程中部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入过量CO2气体:2OH-+CO2═CO32-+H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O═SO42-+Cl-+2H+ | |
| D. | 2 mol•L-1的NaAlO2溶液和5 mol•L-1的盐酸溶液等体积混合均匀:2AlO2-+5H+═A1(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 0.12mol•L-1 | C. | 0.05mol•L-1 | D. | 0.16mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各为0.1 mol的羟基(-OH)和OH-中含有的电子数目均为0.9NA | |
| B. | 标准状况下,22.4 L O2与44.8 L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1 mol的羟基(-OH)和OH-中含有的电子数目均为0.9NA | |
| D. | 1L 0.1 mol/L的NaClO溶液中含有的ClO-离子数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
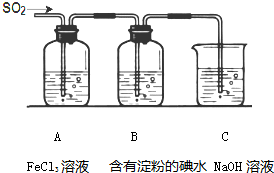 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com