

 .
.分析 ①铜是29号元素,核外有29个电子,根据核外电子排布式规则书写;
②根据晶胞的边长为361pm,其体积为(361pm)3;晶胞的质量=体积×密度;铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子,故铜的摩尔质量=$\frac{1}{4}$×晶胞质量×NA,据此计算NA;
③阴离子处于晶胞的体心、面心、顶点与棱上,利用均摊法计算,阳离子铜位于体心;
④CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4;
⑤根据结构示意图中所有氧原子都是饱和氧原子,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,胆矾属于离子晶体以及胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子等角度分析;
⑥从F原子的电负性的角度分析;
⑦确定二者的晶体类型,比较微粒间作用力判断熔点.
解答 解:①铜是29号元素,核外有29个电子,满足全满半满的稳定结构,其核外电子排布式是1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
②1pm=10-10cm,故一个晶胞的体积为(361×10-10cm)3=4.7×10-23cm3;晶胞的质量=体积×密度,故一个晶胞的质量为4.7×10-23cm3×9.00g•cm-3=4.23×10-22g;铜的晶胞为面心立方最密堆积,一个晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故铜的摩尔质量=$\frac{1}{4}$×晶胞质量×NA,所以63.6g•mol-1=$\frac{1}{4}$×4.23×10-22g×NA,得NA=6.01×1023mol-1,
故答案为:4.7×10-23;4.23×10-22;6.01×1023mol-1;
③从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为:8×$\frac{1}{8}$+4×$\frac{1}{4}$+2×$\frac{1}{2}$+1=4,Cu位于晶胞内部,则平均一个晶胞含有4个Cu,
故答案为:4;4;
④CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.水合铜离子的结构简式为 ,
,
故答案为: ;
;
⑤A.该结构中的氧原子部分饱和,部分不饱和,杂化方式不同.从现代物质结构理论出发,硫酸根离子中S和非羟基O之间除了形成1个σ键之外,还形成了反馈π键.形成π键的电子不能处于杂化轨道上,O必须保留未经杂化的p轨道,就不可能是sp3杂化,故A错误;
B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,故B正确;
C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,故C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,故D正确;
故答案为:BD;
⑥F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子,
故答案为:NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键;
⑦Cu2O与Cu2S相比,两种化合物均属于离子晶体,由于晶体中O2-半径小于S2-,则Cu2O的晶格能高于Cu2S,即熔点高于后者,
故答案为:高;Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高.
点评 本题以铜元素及其化合物为载体,综合考查物质结构与性质的主干知识,侧重考查核外电子排布式、化学键类型判断、配位键、晶格能判断,注意晶胞的结构为解答难点,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||


查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学式 | 沉淀开始时的pH | 沉淀完全时的pH | 有关性质 |
| Co(OH)2 | 7.2 | 9.4 | Co+2HCl═CoCl2+H2↑ Co2++2NH3•H2O═Co(OH)2↓+2NH4+ Co2++2H2O?Co(OH)2+2H+ Ni+2HCl═NiCl2+H2↑ Ni2++6NH3•H2O═Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 7.1 | 9.6 | |
| Fe(OH)3 | 2.3 | 3.7 | |
| Mg(OH)2 | 10.8 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
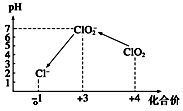 二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀的pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全的pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com