
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
分析 (1)①A、没有标明正逆反应速率,无法判断平衡状态;
B、由于反应前后气体的化学计量数之和不相等,压强不变,达到了平衡状态;
C、由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态;
D、氨气体积分数不变,不能说明正逆反应速率相等,各组分浓度不变;
②根据化学平衡常数的表达式进行计算.
③根据平衡移动原理判断;
④根据温度对化学平衡移动的影响以及反应前后气体量的变化来确定焓变和熵变的符号;
(2)⑤根据化学反应速率的公式V=$\frac{△c}{△t}$计算;
⑥由图象数据可以得出,用不同初始浓度,不同温度下的平均速率的大小来说明.
解答 解:(1)①A、没有标明正逆反应速率,无法判断平衡状态,故A错误;
B、由于反应前后气体的化学计量数之和不相等,压强不变,达到了平衡状态,故B正确;
C、由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故正确;
D、氨气体积分数不变,不能说明正逆反应速率相等,各组分浓度不变,故D错误;
故选BC;
②根据反应:NH2COONH4(s)?2NH3(g)+CO2(g),n(NH3)=2n(CO2),所以K=c(CO2)=$\frac{1}{3}$×4.8×10-3mol•L-1=1.6×10-3mol•L-1,c(NH3)=$\frac{2}{3}$×4.8×10-3mol•L-1=3.2×10-3mol•L-1,依据平衡常数的表达式,25.0℃时氨基甲酸铵的分解平衡常数为:1.6×10-3mol•L-1×(3.2×10-3mol•L-1)2≈1.6×10-8(mol•L-1)3,
故答案为:K=1.6×10-8(mol•L-1)3;
③压缩容器体积,增大了压强,平衡向着逆向移动,氨基甲酸铵固体的质量增加,故答案为:增加;
④根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热的,反应物是固体,产物是气体,该反应是熵增加的过程,即△H>0,△S>0,故答案为:>;>;
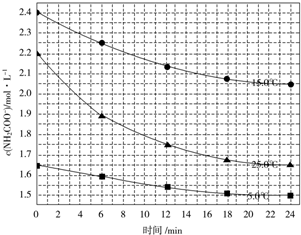
(2)⑤化学反应速率V=$\frac{△c}{△t}$=$\frac{2.2mol/L-1.9mol/L}{6min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
⑥因25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大,
故答案为:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
点评 本题考查了化学平衡状态的判断,平衡常数的计算、反应速率的计算等,注重了基础知识的考查,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钾投入水中 | B. | 镁条放入冷水中 | ||
| C. | KSCN溶液滴加到FeCl3溶液中 | D. | 氯水滴加到KI淀粉溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com