
分析 (1)根据焦硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸,即n(H2SO4)=2n(H2SO4•SO3),结合公式c=$\frac{n}{V}$来求硫酸的物质的量浓度;
(2)根据浓硫酸吸水后生成H2SO4•H2O计算,硫酸与水的物质的是为1:1.
解答 解:(1)n(H2SO4)=2n(H2SO4•SO3)=$\frac{890g}{178g/mol}$×2=10mol,所以该硫酸的物质的量浓度为c(H2SO4)=$\frac{10mol}{8.00L}$=1.25mol/L,
故答案为:1.25;
(2)n(H2SO4•H2O)=n(H2SO4)=$\frac{500g×98%}{98}$=5mol,所以吸收水的质量为:5mol×116g/mol-500g=80g,
故答案为:80g.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式即可解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
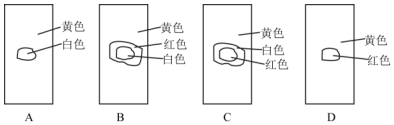
 、
、 、
、 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,乙中CO2的转化率大于60% | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol•L-1 | |
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾 | B. | 蛋白质溶液 | C. | 石灰乳 | D. | 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
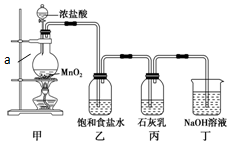 某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.
某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1mol H2O在标准状况下的体积为22.4 L | |
| D. | 1L 1mol•L-1K2SO4溶液中含有的钾离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH和AlCl3 | B. | 稀盐酸和NaOH | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 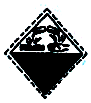 | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com