
某化学研究性学习小组拟利用下列装置和药品进行四氯化锡的制备。供选择的药品:4.8gSn、浓HCl、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰。
仪器装置:
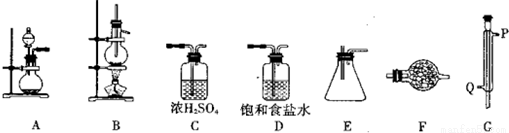
已知四氯化锡具有强的吸水性,水解生成锡的氧化物。
SnCl4和Sn的部分数据如下:
密度/(g·cm-3) | 熔点/℃ | 沸点/℃ | |
四氯化锡 | 2.2 | -33 | 114 |
金属锡 | 5.77 | 231 | |
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A  ____
____ _____
_____ _____
_____ _____
_____

(2)仪器G的名称是_______实验时,冷却水的流向是从_________进入(填符号)
(3)A中反应的离子方程式 ;
(4)F中盛装的化学试剂是_________;作用是 、 。写出SnCl4水解的化学方程式
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:2015-2016学年广东汕头金山中学高一上12月月考化学卷(解析版) 题型:选择题
以下各组离子中,在pH=13.0的溶液中能大量共存的是
A.Na+、K+、Cl-、AlO2- B.Ba2+、NO3-、HCO3-、Br-
C.Cu2+、K+、S2-、SO42- D.K+、SO32-、NO3-、MnO4-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列叙述错误的是
A.标准状况下,1molSO3(s)的体积约为22.4L
B.100mL0.10 mol·L-1AlCl3溶液中,Cl-的数目为0.03NA
C.18g水中,电子的数目为10NA
D.3molCu与稀硝酸完全反应,被还原的NO3-数目为2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上期中测试化学试卷(解析版) 题型:选择题
向含有下列四种离子:①HCO3-、②Cl-、③Na+、④CO32-的溶液中加入烧碱固体。以上四种离子的物质的量变化正确的是( )
A.①不变②不变③增大④增大 B.①不变②不变③增大④不变
C.①减小②不变③增大④不变 D.①减小②不变③增大④增大
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列中学常见实验的现象或表述正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
下列行为中不符合“促进低碳经济”宗旨的是( )
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
B.尽量使用含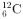 的产品,减少使用含
的产品,减少使用含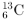 或
或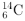 的产品
的产品
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
查看答案和解析>>
科目:高中化学 来源:2016届吉林长春外国语学校高三上第一次质检化学试卷(解析版) 题型:推断题
A、B、C、D、E是短周期中原子序数依次增大的主族元素,其中元素A的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。常温常压下,E单质是淡黄色固体,常在火山口附近沉积。
(1)CA与水反应放出气体的化学方程式为 。
(2)B 元素的元素符号: ;CA的电子式为 ;
D在元素周期表中的位置为 。
(3)A2E的燃烧热ΔH = -a kJ·mol-1,写出A2E燃烧反应的热化学方程式: 。
(4)甲、乙、丙分别是B、D、E三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
① 向丙溶液中缓慢滴加过量的乙溶液过程中发生反应的离子方程式 , 。
② 向甲溶液中缓慢滴加等物质的量的丙溶液后,所得溶液中离子浓度由大到小的顺序为 。
(5)用D单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式: ;由R生成Q的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西师范大学附属中学高三第一次模拟理化学试卷(解析版) 题型:填空题
(14分)工业制硝酸的主要反应为:4NH3 (g) +5O2 (g)  4NO(g) + 6H2O(l) △H
4NO(g) + 6H2O(l) △H
(1)已知氢气的燃烧热为285.8kJ/mol。
N2(g)+3H2(g)═ 2NH3(g)△H = ﹣92.4kJ/mol;
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则上述工业制硝酸的主要反应的△H= 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
起始 | 0.8 | 1.6 | 0 |
第2min | 0.6 | a | 0.2 |
第4min | 0.3 | 0.975 | 0.5 |
第6min | 0.3 | 0.975 | 0.5 |
第8min | 0.7 | 1.475 | 0.1 |
①反应在第2min到第4min时,O2的平均反应速率为 。
②反应在第6min时改变了条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g)达到平衡状态的是_________ (填序号)。
4NO(g) + 6H2O(g)达到平衡状态的是_________ (填序号)。
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O) = 4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
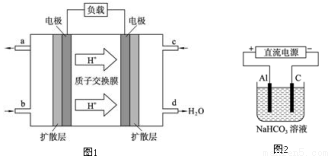
(3)某研究所组装的CH3OH﹣O2燃料电池的工作原理如图1所示。
①该电池工作时,b口通入的物质为 。
②该电池正极的电极反应式为: 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现溶液逐渐变浑浊并有气泡产生,其原因可能是 (用相关的离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:推断题
已知常温下B、D、E、L为密度比空气大的气体,D、E为单质,其他为化合物。A是一种淡黄色固体,C微溶于水,F、G均能与L的水溶液反应放出B。据下边反应框图填空。
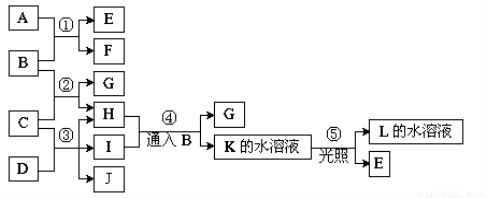
(1)F的俗名是 ,B分子的结构式为____工业上利用反应③生产 。
(2)反应④的离子方程式为 。
(3)有一种单质能与H反应生成E,该反应的化学方程式为 。
(4)某气体M具有漂白作用,既有氧化性,又有还原性,M通入D的溶液中反
应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com