
| A、1 | B、2 | C、3 | D、4 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (1)现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:| c(B) |
| c(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
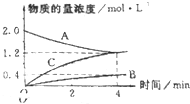 如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:
如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、味精的主要成分为蛋白质,烧菜时可加入适量 |
| B、养鸭厂添加苏丹红制“红心鸭蛋”,可使鸭蛋色泽鲜艳、美观 |
| C、汽水中添加林丹、毒死蜱和七氯苯等药剂制“××可乐”,以增强口感和余味 |
| D、既能为人体提供热量,又能提供必需脂肪酸的物质是油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、CO32-、SO42- |
| B、Fe2+、NO3-、H+ |
| C、NH4+、Cl-、HCO3- |
| D、K+、H+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、HCO3-、NO3- |
| B、Mg2+、K+、NO3-、Na+ |
| C、H+、Zn2+、SO42-、NO3- |
| D、Na+、SO42-、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、OH-Ba2+NO3-K+ |
| B、Na+ SO42- Cu2+ Cl- |
| C、HCO3- Cl- Na+ Ba2+ |
| D、Fe3+ Al3+ Br- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅是人类将太阳能转变为电能的常用材料 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| D、粗硅制备单晶硅不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3═NH4++HCO3- |
| B、Ba(NO3)2═Ba2++2NO3- |
| C、KAl(SO4)2═K++Al3++2SO42- |
| D、Ca(OH)2═Ca2++(OH)2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com