
下列关于置换反应M+X→N+Y其中M、N为单质,X、Y为化合物,(反应条件已略去)的说法中正确的是
A.若X为氧化物,则Y也一定是氧化物
B.若M为金属单质,则N一定为金属单质
C.若X是不含金属元素的化合物,则N一定是非金属单质
D.若X是含有金属元素的化合物,则Y一定含有金属元素的化合物
科目:高中化学 来源:2016-2017年新疆兵团第二师华山中学高二上学前考化学卷(解析版) 题型:选择题
某溶液中只含有K+、Fe3+、NO3-,已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO3-的个数比为( )
A.1:4 B.1:2 C.3:4 D.3:2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高一上开学考化学卷(解析版) 题型:选择题
下列转化能一步完成的是
①CH4→CO2 ②HNO3→HCl ③CaO→Ca(OH)2 ④Ba(OH)2→NaOH ⑤C→Cu
A.①③④⑤ B.②③④⑤ C.①②④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一上开学考化学卷(解析版) 题型:选择题
通过下列图示实验得出的结论中正确的是
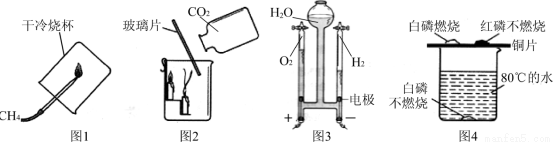
A.图1所示实验既说明甲烷具有可燃性,又说明甲烷中只含有碳、氢两种元素
B.图2所示实验既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧
C.图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的
D.图4所示实验既可探究可燃物的燃烧条件,又说明红磷不是可燃物
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:实验题
CaS用于制备除虫剂、发光材料等。某课题组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图实验装置检验气体产物:
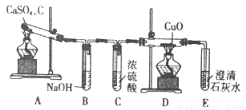
①B装置作用是 ;
②D和E装置能检验装置A的反应产物是 ;
③E装置中可能出现的现象是 。
(2)乙同学提出,根据氧化还原反应,A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计方案(同一种仪器可重复使用)。
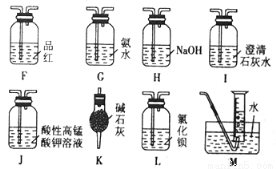
①气流从左至右,仪器连接顺序为A、F 。
②能证明有SO2的现象是 ;能证明有CO2的现象是 。
③除去SO2的离子方程式为 。
(3)经试验检验气体产物有SO2、CO、CO2且气体体积之比为1:1:2,写出A中反应的化学方程式 。
(4)利用重量法测定固体产物的质量之比,即将样品溶于足量的饱和碳酸钠溶液,过滤洗涤、干燥等。需要测定的物理量有 。(已知CaS与H2O反应生成Ca(OH)2和H2S)
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:选择题
元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是
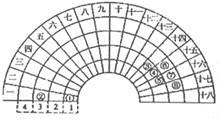
A. ③元素形成的单质晶体均属于原子晶体
B. ②、⑦、⑧对应的简单离子半径依次减小
C. ②⑤形成的化合物阴阳离子个数比可能为1:1
D. ④元素的气态氢化物易液化,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:选择题
唐代中药学著作《新修本草》中,有关于“青矾”的记录为:“本来绿色,新出窟未见风者,正如瑠璃……烧之赤色”。据此推测,“青矾”的主要成分为
A.CuSO4·5H2O B.FeSO4·7H2O C.KAl(SO4)2·12H2O D.Fe2(SO4)3·9H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
下列说法错误的是
①化学性质相似的有机物是同系物 ②分子组成相差一个或若干个CH2原子团的有机物是同系物 ③若烃中碳、氢元素的质量分数相同,它们必是同系物 ④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似 ⑤相对分子质量相同而结构不同的化合物互为同分异构体 ⑥石墨与金刚石分子式相同,结构不同,互为同分异构体
A.①②③④⑤⑥ B.只有②③⑤ C.只有③④⑥ D.只有①②③⑥
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上8月月考理综化学试卷(解析版) 题型:填空题
某些电镀厂的酸性废水中常含有一定量的CrO42-和Cr2O72-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法,该法的工艺流程为:
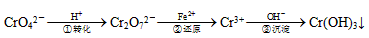
其中第①步存在平衡步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,该溶液显________色。
(2)写出第③步的离子反应方程式:__________。
(3)第②步中,用6mol的FeSO4·7H2O可还原________molCr2O72-离子。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法:该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)写出阳极的电极反应式___________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)__________________________
(7)用电镀法在铁制品上镀上一层锌,则阴极上的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com