
将下列四组溶液在烧杯中分别同时迅速混合,此时,硫代硫酸钠和盐酸缓慢地进行反应,则出现浑浊的先后顺序是( )
① 20℃ 10mL 5.4mol/L的Na2S2O3溶液和20mL 1.5mol/L盐酸 ② 20℃ 10mL 4.0mol/L的Na2S2O3溶液和10mL 2.0mol/L盐酸③ 30℃ 15mL 3.5mol/L的Na2S2O3溶液和10mL 2.5mol/L盐酸 ④ 30℃ 20mL 3.0mol/L的Na2S2O3溶液和10mL 3.0mol/L盐酸
A.③④②① B.①②③④ C.④③②① D.④①③②
科目:高中化学 来源:2016届安徽省皖江名校高三上学期12月联考化学试卷(解析版) 题型:填空题
CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益.
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-820kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H3=-566kJ/mol
则反应的CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)工业上,可利用太阳能以CO2为原料制取C,其原理如下图所示:
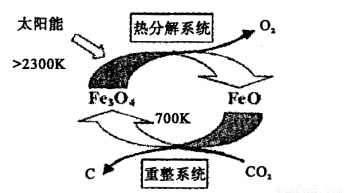
整个过程中__________(填“Fe3O4”或“FeO”)是反应的催化剂。重整系统中发生的反应为6FeO+CO2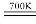 2Fe2O3+C,每生成1molFe3O4,转移电子的物质的量为____________。
2Fe2O3+C,每生成1molFe3O4,转移电子的物质的量为____________。
(3)CO2还可用于合成甲醇,其热化学方程式为:CO2(g)+H2(g) CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
①该反应的平衡常数表达式为____。
②在恒容的密闭容器中,加入H2和CO2的混合气体,不同温度条件,反应相同时间后,测得甲醇的体积分数甲(CH3OH)如图所示。图中A、B、C、D、E五个点对应的状态中,处于平衡状态的是 _______ (填字母),B点和E点的反应速率大小关系为v(B) v(E)(填“>”、“<”、“=”)。
③一定温度下,在甲、乙两个容积相同的密闭容器中,加入H2和CO2的混合气体。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g) |
甲容器平衡后气体的压强为开始时的80%,要使乙容器达平衡时与甲容器达到相同的平衡状态,且起始时反应逆向进行,则c的取值范围为___________。
查看答案和解析>>
科目:高中化学 来源:2016届天津市等六校高三上学期期中联考化学试卷(解析版) 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
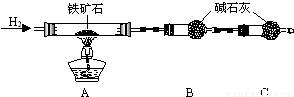
①按如图组装仪器, ;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)补全步骤①的操作 .
(2)装置C的作用为 .
(3)测得反应后装置B增重1.35g,则铁矿石中氧的质量百分含量为 .
Ⅱ.铁矿石中含铁量的测定

(1)步骤④中煮沸的作用是 .
(2)下列有关步骤⑥的操作中说法正确的是 .
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(3)若滴定过程中消耗0.5000mol•L﹣1的KI溶液22.50mL,则铁矿石中铁的质量百分含量为 .
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省五校高一上第一次月考化学试卷(解析版) 题型:选择题
用NA表示的值,下列叙述正确的是( )
A.64g SO2含有氧原子数为NA
B.0.5mol/L MgCl2溶液,含有Cl﹣离子数为NA
C.标准状况下,22.4L H2O的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省、泥河中学高二上12月联考化学试卷(解析版) 题型:填空题
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
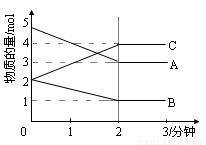
(1)该反应的化学方程式: ;
(2)反应开始至2min末,A的反应速率为 ;
(3)该反应是由 开始进行的。填序号
①正反应 ②逆反应 ③正逆反应同时
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中(理)化学试卷(解析版) 题型:推断题
现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 所有元素中电负性最大的元素 |
X | L层p电子数比s电子数多2个 |
Y | 其最高价氧化物呈两性 |
Z | L层有三个未成对电子 |
(1)写出元素X电子排布式 。
(2)Z原子共有 种运动状态不同的电子。
(3)写出Z元素形成的单质的结构式: 。
(4)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述 中能证明这一事实的是
A、常温下氯气的颜色比T单质的颜色深
B、T的单质通入氯化钠水溶液不能置换出氯气
C、氯与T形成的化合物中氯元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 (填化学式),理由 。
(6)T与Z形成的化合物含有的化学键类型 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中(理)化学试卷(解析版) 题型:选择题
金属的下列性质中,与自由电子无关的是
A.易导热 B.容易导电 C.延展性好 D.密度大小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中(文)化学试卷(解析版) 题型:选择题
在一个2L的容器内充入6.0mol某气态反应物,经过3s后,它的浓度变成1.2mol/L,在3s内用该反应物浓度的变化表示的反应速率为
A.0.6mol·L—1·s—1 B.0.8mol·L—1·s—1
C.0.4mol·L—1·s—1 D.2.4mol·L—1·s—1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上学期期中考试化学试卷(解析版) 题型:选择题
将BaO2放入密闭的真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.氧气浓度不变 D.BaO2量减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com