
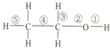
 已知乙醇中不同的化学键如图,关于乙醇在各种不同反应中断裂的键的说明不正确的是( )
已知乙醇中不同的化学键如图,关于乙醇在各种不同反应中断裂的键的说明不正确的是( )| A. | 和浓H2SO4共热,140℃时键①②断裂 | B. | 在Ag催化下和O2反应键①③断裂 | ||
| C. | 和浓H2SO4共热,170℃时②⑤键断裂 | D. | 和氢溴反应键①断裂 |
分析 乙醇含有-OH,可发生取代、氧化和消去反应,可与钠反应,结合官能团的性质判断可能的共价键的断裂方式,以此解答.
解答 解:A.乙醇和浓H2SO4共热至140℃时,发生分子间脱水,生成乙醚,反应方程式为2CH3CH2OH $→_{140℃}^{浓硫酸}$CH3CH2O CH2CH3+H2O,故乙醇断键的位置为:①和②,故A正确;
B.在铜或银催化共热下与O2反应生成乙醛,则断裂①和③,故B正确;
C.乙醇和浓H2SO4共热至170℃时,发生消去反应,生成乙烯,反应方程式为CH3CH2OH $→_{170℃}^{浓硫酸}$CH2═CH2+H2O,故乙醇断键的位置为:②和⑤,故C正确;
D.和氢溴反应生成溴乙烷,键②断裂,故D错误.
故选D.
点评 本题考查有机物的结构和性质,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质和结构特点,学习中注意乙醇的性质,难度不大.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:解答题
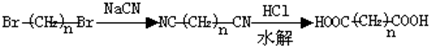 现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下:
现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下: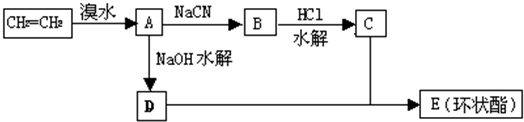
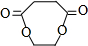 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
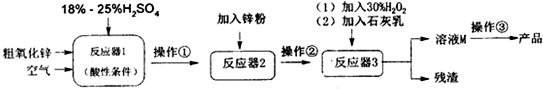
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 分子中一定含有氧原子 | D. | 此有机物的最简式为CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的金属性比镓强,铝的熔点比镓低 | |
| B. | 铝表面形成致密的氧化膜,所以可以用铝制容器来腌制咸菜 | |
| C. | Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应 | |
| D. | 铝镓合金与水反应后的物质可以回收利用冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:A>C | |
| B. | 可用单质的活泼性来比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | E元素的某化合物A2E2O8中E的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24LO2 | B. | 含NA个氢原子的H2 | ||
| C. | 22gCO2 | D. | 含3.01×1023个分子的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在0.10mol•L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大 | |
| B. | 常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7 | |
| C. | pH均为5 的盐酸和硫酸氢钠溶液中,水的电离程度后者大 | |
| D. | pH=3的0.1 mol•L-1HA溶液与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com