
分析 Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性;碳酸氢钠受热易分解,碳酸钠水解产物为氢氧化钠和碳酸氢钠,加热蒸干是蒸发水,得到碳酸钠固体;在混合溶液中滴加稀盐酸,若碳酸钠与碳酸氢钠完全反应,则所得溶液因溶解了生成的二氧化碳而显酸性;若溶液呈中性,则溶液中应有少量NaHCO3剩余,所以溶质的主要成分有NaCl、NaHCO3、CO2;
解答 解:Na2CO3是强碱弱酸盐,CO32-水解导致溶液呈碱性,分步水解,溶液碱性取决于第一步,水解离子方程式为CO32-+H2O?HCO3-+OH-,碳酸氢钠受热易分解得到Na2CO3,NaHCO3加热蒸干灼烧得到的固体物质是碳酸钠,在混合溶液中滴加稀盐酸,若碳酸钠与碳酸氢钠完全反应,则所得溶液因溶解了生成的二氧化碳而显酸性;若溶液呈中性,则溶液中应有少量NaHCO3剩余,所以溶质的主要成分有NaCl、NaHCO3、CO2,
故答案为:CO32-+H2O?HCO3-+OH-,Na2CO3;NaHCO3 、NaCl、CO2;
点评 本题考查了盐类水解原理,离子方程式的书写,反应产物判断,题目难度不大,注意明确物质加热、蒸干、灼烧得到产物的分析方法和产物判断,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氨水、水玻璃、漂白粉属于电解质 | |
| B. | Cl2、SO2均使品红溶液褪色,但原理不相同 | |
| C. | 同温同压下,相同体积的任何气体都含有相同的原子数 | |
| D. | Na2O2、FeO是碱性氧化物;NO2、SO3是酸性氧化物;Al2O3、SiO2是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| B. | 当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 当滴入20mL NaOH溶液时:2c(SO42-)═c(NH3•H2O)+c(NH4+) | |
| D. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•molˉ1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•molˉ1 | |
| B. | 由C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•molˉ1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OHˉ(aq)=H2O(l)△H=-57.3 kJ•molˉ1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 一定条件下,某密闭容器中充入2 mol SO2(g)和1 mol O2(g),达到平衡后,放出Q kJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H=-Q kJ•molˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂 | |
| C. | Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
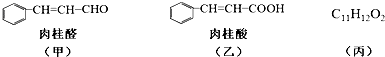
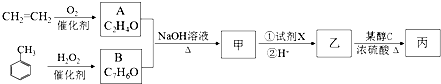
 .
. $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$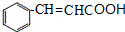 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
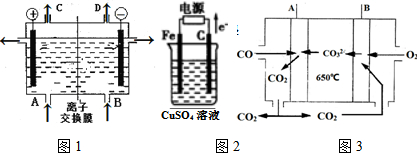
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同种物质 | B. | 不同密度的核素 | ||
| C. | 同位素 | D. | 相同元素构成的不同单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com