
| A. | 反应4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K12/K2 | |
| B. | 平衡后c(Cl2)=2.5×10-2mol/L | |
| C. | 其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 | |
| D. | 平衡时NO2的转化率为50% |
分析 A.①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),平衡常数K1=$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$,
②2NO(g)+Cl2(g)?2ClNO(g),平衡常数K2 =$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$,
2×①-②可得4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),进而计算平衡常数$\frac{{c}^{2}(NO)×c(C{l}_{2})}{{c}^{4}(N{O}_{2})}$;
B.10min时反应达到平衡,测得容器内体系的压强减少20%,则平衡时混合气体总物质的量为(0.2+0.2+0.1)mol×(1-20%)=0.4mol,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol•L•min-1,则平衡时n(ClNO)=7.5×10-3mol•L•min-1×10min×2L=0.15mol,设①中反应的NO2为xmol,②中反应的Cl2为ymol,则:
2NO2(g)+NaCl(s)═NaNO3(s)+ClNO(g)
xmol 0.5xmol
2NO(g)+Cl2(g)═2ClNO(g)
2ymol ymol 2ymol
再根据ClNO物质的量与平衡时混合气体总物质的量列方程计算解答;
C.平衡常数只受温度影响,温度不变,则为平衡常数不变;
D.根据C中的计算结果,可以计算二氧化氮的转化率.
解答 解:A.①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),平衡常数K1=$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$;
②2NO(g)+Cl2(g)?2ClNO(g),平衡常数K2 =$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=$\frac{{c}^{2}(NO)×c(C{l}_{2})}{{c}^{4}(N{O}_{2})}$,
则[$\frac{c(ClNO)}{{c}^{2}(N{O}_{2})}$]2÷$\frac{{c}^{2}(ClNO)}{{c}^{2}(NO)×c(C{l}_{2})}$=$\frac{{c}^{2}(NO)×c(C{l}_{2})}{{c}^{4}(N{O}_{2})}$,即K=$\frac{{{k}_{1}}^{2}}{{k}_{2}}$,故A正确;
B.10min时反应达到平衡,测得容器内体系的压强减少20%,则平衡时混合气体总物质的量为(0.2+0.2+0.1)mol×(1-20%)=0.4mol,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol•L•min-1,则平衡时n(ClNO)=7.5×10-3mol•L•min-1×10min×2L=0.15mol,设①中反应的NO2为xmol,②中反应的Cl2为ymol,则:
2NO2(g)+NaCl(s)═NaNO3(s)+ClNO(g)
xmol 0.5xmol
2NO(g)+Cl2(g)═2ClNO(g)
2ymol ymol 2ymol
则0.5x+2y=0.15,(0.2-x+0.2-2y+0.1-y)+0.5x+2y=0.4,联立方程,解得x=0.1、y=0.05,
故平衡后c(Cl2)=$\frac{0.1mol-0.05mol}{2L}$=2.5×10-2mol•L-1,故B正确;
C.平衡常数只受温度影响,其他条件保持不变,反应在恒压条件下进行,则平衡常数K2不变,故C错误;
D.平衡时NO2的转化率为$\frac{0.1mol}{0.2mol}$×100%=50%,故D正确,
故选C.
点评 本题考查了化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,题目还涉及化学平衡常数、影响化学平衡的因素分析应用判断,注意把握计算的思路、方法,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 据报道,以硼氢化合物 NaBH4(B 元素的化合价为+3 价)和 H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用 MnO2,可用作空军通信卫星电源,其工作原理如图所 示.下列说法正确的是( )
据报道,以硼氢化合物 NaBH4(B 元素的化合价为+3 价)和 H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用 MnO2,可用作空军通信卫星电源,其工作原理如图所 示.下列说法正确的是( )| A. | 电池放电时 Na+从 b 极区移向 a 极区 | |
| B. | 每消耗 3mol H2O2,转移的电子为3mol | |
| C. | 电极 a 采用 MnO2,MnO2 既作电极材料又有催化作用 | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂降低反应的活化能来提高化学反应效率 | |
| B. | 油脂和纤维素都属于高分子化合物 | |
| C. | 神州飞船的防护层中含聚四氯乙烯,合成它的单体属于卤代烃 | |
| D. | 中国古代利用明矾溶液的酸性清洗铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12753I和13153I是质子数相同的同种核素 | |
| B. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 | |
| C. | 实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的皂化反应可得到高级脂肪酸与甘油 | |
| B. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 | |
| C. | 可以淀粉为原料制取乙酸乙酯 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
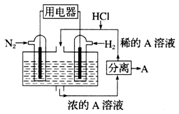 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )| A. | A为NH4Cl | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 该电池外电路电子从通入N2的电极流向通入H2的电极 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都不能用铝制容器贮存 | |
| B. | 滴在紫色石蕊试纸上,试纸都变黑 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com