
【题目】(1)配平该反应的化学方程式:___
① FeSO4+ KMnO4+ H2SO4= K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
②该反应中的氧化剂是___,氧化产物是____。
③若消耗3.16gKMnO4,则该反应转移的电子数目为____。
(2)已知反应:①Cl2+2KBr=2KCl+Br2,②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,③Br2+K2S=2KBr+S。
①下列说法正确的是__。
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为KMnO4>Cl2>Br2>S
C.反应②中还原剂与氧化剂的物质的量之比为8:1
D.反应③中1mol还原剂被氧化则转移电子的物质的量为2mol
②用单线桥法标出反应②中电子转移的方向和数目___。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
【答案】10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O KMnO4 Fe2(SO4)3 0.1NA BD 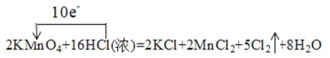
【解析】
(1)①该反应中Mn元素的化合价从+7价降低到+2价,Fe元素的化合价从+2价升高到+3价,根据得失电子守恒、元素守恒配平该方程式;
②根据化合价的变化判断;
③Mn元素的化合价从+7价降低到+2价,计算3.16g KMnO4的物质的量,从而计算高锰酸钾得电子数,转移电子数=氧化剂得电子数=还原剂失电子数,计算该反应转移的电子数目;
(2)①A.置换反应为一种单质和一种化合物反应生成另一种单质和另一种化合物;
B.根据氧化剂的氧化性大于氧化产物的氧化性判断;
C.根据化合价变化判断氧化剂、还原剂以及物质的量之比;
D.根据化合价变化判断还原剂以及转移电子物质的量;
②用单线桥法标出反应中电子转移的方向和数目时,电子从还原剂转移到氧化剂,根据化合价变化判断转移电子数目。
(1)①该反应中Mn元素的化合价从+7价降低到+2价,Fe元素的化合价从+2价升高到+3价,根据得失电子守恒、元素守恒配平该方程式为:10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O;
故答案为:10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O;
②该反应中Mn元素的化合价从+7价降低到+2价,得电子,被还原,KMnO4为氧化剂,Fe元素的化合价从+2价升高到+3价,失电子,被氧化,得到氧化产物,因此氧化产物为:Fe2(SO4)3;
古答案为:KMnO4;Fe2(SO4)3;
③3.16g KMnO4的物质的量为:![]() ,则其得电子数为:0.02mol×(7-2)=0.1mol,转移电子数=氧化剂得电子数=还原剂失电子数,则该反应转移的电子数目为0.1NA;
,则其得电子数为:0.02mol×(7-2)=0.1mol,转移电子数=氧化剂得电子数=还原剂失电子数,则该反应转移的电子数目为0.1NA;
故答案为:0.1NA;
(2)①A.置换反应为一种单质和一种化合物反应生成另一种单质和另一种化合物,则①③为置换反应,②不是置换反应,A项错误;
B.在反应①中,氯气是氧化剂,溴单质为氧化产物,反应②中高锰酸钾为氧化剂,氯气是氧化产物,反应③中溴单质为氧化剂,硫单质为氧化产物,根据氧化剂的氧化性大于氧化产物的氧化性可知,氧化性由强到弱顺序为KMnO4>Cl2>Br2>S,B项正确;
C.在反应②中②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,高锰酸钾为氧化剂,但只有部分盐酸为还原剂,当2mol高锰酸钾参加反应时,只有10mol盐酸被氧化,还原剂与氧化剂的物质的量之比为5:1,C项错误;
D.反应中③Br2+K2S=2KBr+S,还原剂为硫离子,1mol还原剂被氧化则转移电子的物质的量为2mol,D项正确;
故答案为:BD;
②用单线桥法标出反应②中电子转移的方向和数目 ;
;
故答案为: 。
。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(![]() )配制100mL浓度为1 molL1的稀硫酸,其操作步骤可分解为以下几步:
)配制100mL浓度为1 molL1的稀硫酸,其操作步骤可分解为以下几步:
a.用量筒量取___________mL的浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌.
b.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入M里.
c.将稀释后的硫酸小心地用玻璃棒引流入M.
d.检查M是否发生滴漏.
e.将蒸馏水直接加入M,至液面接近刻度线2cm至3cm处.
f.盖紧瓶塞,反复倾倒振荡,摇匀溶液.
g.用________________向M里逐滴滴入蒸馏水,至液面最低点恰好与环形刻度线相切.据此填写:
(1)正确的操作顺序是______.
(2)进行A步操作时,应量取______mL浓硫酸,选用量筒的规格是(填序号) _________.
a. 10mL b. 50mL c. 1000mL d. 1000mL
(3)配置上述溶液时,多次提到的实验仪器M是______________。步骤G中横线处是_________。
(4)进行A步骤操作时,必须_____后,才能进行后面的操作.
(5)实验操作中,下列操作会对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)
a.洗涤烧杯和玻璃棒的溶液未转入M中__________________
b.定容时,眼睛俯视溶液____________________
c.容量瓶中原残留少量蒸馏水__________________
d.定容后M中液面低于刻度线,又加水定容到刻度线.____________________
e量取浓硫酸时仰视量筒读数____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应:
Cu+2H2SO4(浓)![]() CuSO4+ SO2 ↑ +2H2O
CuSO4+ SO2 ↑ +2H2O
(1)取一定量的铜片与100mL18mol/L的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,计算生成的CuSO4的质量_______和生成的SO2气体在标准状况下体积_______(假设气体全部逸出)。
(2)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应,计算:反应后所得沉淀的质量_______(保留到0.1g)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O═Cu2O+H2↑。下列说法正确的是( )
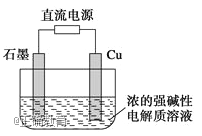
A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1mol电子转移时,有0.1molCu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )

A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
![]()
A. Z元素的最高价氧化物水化物的酸性强于Y
B. 要使由Y元素形成的YO2晶体融化,需要破坏共价键
C. 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最稳定
D. 氢化物WH3与HZ反应生成的离子化合物中存在10e-、18 e-两种微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)7.8g Na2R含有0.2mol Na+,则Na2R的摩尔质量为______
(2)将4g NaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为______.
(3)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为______.
(4)标准状况下,3.4g NH3与标准状况下______LH2S含有相同数目的氢原子。
(5)同温同压,等质量的O2和SO2,它们的物质的量之比为______,所含原子数之比为______,密度之比______.
(6)标准状况下,将VL HCl气体溶于100mL水(密度是1g/mL)中,所得溶液密度为ρg/mL,则此盐酸的物质的量浓度为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水,易溶于浓盐酸形成络合离子([CuCl2]-)。受潮露置空气中迅速氧化成碱式盐。实验室用下列流程制备:

已知:Na[CuCl2](易电离,溶液无色) ![]() NaCl+CuCl↓(白色沉淀)。
NaCl+CuCl↓(白色沉淀)。
请回答以下问题:
(1)写出实验室制取Na[CuCl2]的离子方程式__________
(2)判断步骤②反应完全的现象是____________
(3)步骤③的目的是__________________________________。
(4)步骤④有关抽滤操作,下列说法正确的是_______
A. 选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B. 在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C. 抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D. 洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(5)定量 称取1.850g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol·L-1FeCl3溶液中,加水稀释至200mL得到溶液,取20.00mL 用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗18.00mLCe(SO4)2 。
①此实验涉及溶液配制与定量滴定的基本操作中,其中合理的是___________;
②有关反应式:Fe3++CuCl=Fe2++Cu2++Cl- Ce4++Fe2+=Fe3++Ce3+则样品中CuCl的质量分数____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示:
![]()
下列判断不合理的是( )
A. Al、Ga均处于ⅢA族B. Ga2O3可与盐酸反应生成GaCl3
C. 酸性:Al(OH)3>Ga(OH)3D. Ga(OH)3可与NaOH反应生成NaGaO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com