
【题目】某课外活动小组用如图装置进行实验,试回答下列问题。
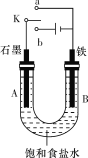
(1)若开始时开关K与a连接,则A极的电极反应式为_____________________。
(2)若开始时开关K与b连接,则B极的电极反应式为____________________。
(3)若用铝条和镁条分别代替图中石墨和铁电极,电解质溶液为氢氧化钠溶液,请写出原电池负极的电极反应式_____________________________。
(4)若用二氧化铅和铅作电极,硫酸溶液为电解质溶液构成铅蓄电池,则充电时阳极的电极反应式_________________。
【答案】O2+4e-+2H2O=4OH- 2H2O+2e-=2OH-+H2↑ Al-3e-+4OH-=AlO2-+2H2O PbSO4+2H2O-2e-=PbO2+4H++SO42-
【解析】
(1)开始时开关K与a连接,构成原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,A极石墨为正极,氧气得电子,发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(2)开关K与b连接,装置为电解池,电解饱和食盐水生成氢气、氯气和氢氧化钠,铁为阴极,发生还原反应,氢离子得到电子生成氢气,电极方程式为2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑),故答案为:2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑);
(3)Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,生成偏铝酸根离子,电极反应式为Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(4)若用二氧化铅和铅作电极,硫酸溶液为电解质溶液构成铅蓄电池,充电时,阳极上硫酸铅失电子和水反应生成二氧化铅、硫酸根离子和氢离子,电极反应式为PbSO4-2e-+2H2O═PbO2+SO42-+4H+,故答案为:PbSO4-2e-+2H2O═PbO2+SO42-+4H+。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是活细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B分别是水、蛋白质;图2中a、b、c依次表示碳、氧、氢
B. 若图1表示细胞干重,则A化合物的是蛋白质
C. 若图1表示正常细胞,则A化合物中不含图2中的b
D. 若图1表示完全脱水的细胞,则此时含量最多的元素为图2中的b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是 ( )
A. 25℃时,0.1 mol·L-1HF溶液中pH=1
B. 该体系中有CaF2沉淀产生
C. Ksp(CaF2)随温度和浓度的变化而变化
D. 加入CaCl2溶液后体系中的c(H+)浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)及其合金在冶金、农业、电气、化工、环保和宇航等重要领域有着广泛的应用和良好的前景,成为国民经济中一种重要的原料和不可替代的战略物质。钼酸钠晶体(Na2MoO4 ·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分 MoS2 )制备钼酸钠晶体和金属钼的流程如图所示:

请回答下列问题:
(1)Na2 MoO 4·2H2O 中 Mo 的化合价是 ________。
(2)已知“焙烧”过程中 MoS2 变成 MoO3,则气体 1 中对大气有污染的是 ________。
(3)“碱浸”过程中生成 Na2MoO4 的化学方程式是 ________;“结晶”的钼酸钠晶体仍含其他杂质,要得到较纯的晶体,还应采取的方法是 ________。
(4)“滤液”的主要成分是 ________。
(5)将过滤操作得到的钼酸沉淀进行高温焙烧,实验室模拟高温焙烧时用于盛放钼酸的仪器是 ________。
(6)钼酸高温焙烧的产物与 Al 在高温下发生反应的化学方程式是 ________。
(7)测得碱浸液中部分离子浓度为:c(MoO42-) =0.4 mol·L-1,c(SO42-) =0.02 mol·L-1。结晶前加入氢氧化钡固体除去SO42-,不考虑加入氢氧化钡固体后溶液体积的变化,当BaMoO4开始沉淀时,SO42- 的去除率为 ________ (保留三位有效数字)。 [已知: Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)填空
①除去硝酸钾中混有的少量氯化钠,操作步骤为:制成热饱和溶液、_______、过滤;
②分离四氯化碳和水的操作名称为_________;
③除去氢气中氯化氢的操作名称为 ________;
(2)从如图装置中选择
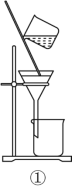
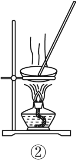
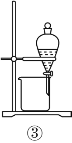
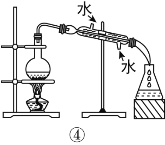
![]()
①除去水中的氯离子,所需装置序号为_______;
②除去铜粉中的锌粉,所需装置序号为 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通直流电用惰性电极电解,3个电解槽串联。
(1)第一个电解槽中盛放500 mL 1 mol/L AgNO3溶液,一段时间后溶液pH由6变为1,忽略电解前后溶液体积变化,试计算阴极上析出单质的质量_____________。
(2)另外2个电解槽盛放KCl,Al2O3的熔融态,计算该电解时间段阴阳极产物的物质的量_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某未知溶液中可能含有Fe2+,确定含该离子的实验方案为:取少量该溶液于试管中,先_________,再__________,则说明溶液中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量氨气 
B. 比较NaHCO3和Na2CO3的热稳定性
C. 制取并检验乙烯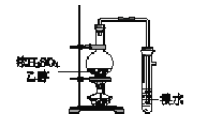
D. 比较盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com