
 X、Y、Z、R、M、Q为前四周期元素,且原子序数依次增大,YZ2是红棕色气体;X与Y元素可形成YX3;R+与Z2-具有相同的核外电子排布;M-的M层电子数是K层上电子的4倍;Q2+离子的3d轨道中有9个电子.
X、Y、Z、R、M、Q为前四周期元素,且原子序数依次增大,YZ2是红棕色气体;X与Y元素可形成YX3;R+与Z2-具有相同的核外电子排布;M-的M层电子数是K层上电子的4倍;Q2+离子的3d轨道中有9个电子.分析 YZ2是红棕色气体,即二氧化氮为红棕色气体,故Y是N元素,Z是O元素;
X与Y元素可形成YX3,且X的原子序数在此六种元素中最小,故X为H元素;
R+与Z2-具有相同的核外电子排布,故R是Na元素;
M-的M层电子数是K层上电子的4倍,故M为Cl元素;
Q2+离子的3d轨道中有9个电子,故Q是Cu元素,
(1)Q是铜,失去1个电子形成阳离子;价层电子对互斥理论确定分子空间构型;依据杂化理论计算;
(2)依据元素周期律知识解答即可;
(3)铜晶体中每个铜原子周围距离最近的铜原子数目=3×8×$\frac{1}{2}$;根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
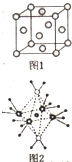
(4)根据图象知,阳离子的配位数是6,阳离子中含有共价键、配位键,氨分子个数是4、水分子个数是2;
(5)将Cu单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,说明得到四氨合铜络离子,还应生成氢氧根离子与水;
(6)根据题干描述书写化学方程式,注意焓变与物质的量的对应关系、注明各物质的状态.
解答 解:YZ2是红棕色气体,即二氧化氮为红棕色气体,故Y是N元素,Z是O元素;
X与Y元素可形成YX3,且X的原子序数在此六种元素中最小,故X为H元素;
R+与Z2-具有相同的核外电子排布,故R是Na元素;
M-的M层电子数是K层上电子的4倍,故M为Cl元素;
Q2+离子的3d轨道中有9个电子,故Q是Cu元素,
(1)Q为Cu,Cu为29号元素,失去1个电子形成离子,故Cu+基态的核外电子排布式是:[Ar]3d10,YX2-是NH2-,NH2-离子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(5-1×2+1)=2+2,即NH2-为V形,H2O中价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3,
故答案为:[Ar]3d10;V形;sp3;
(2)A、组成相似的同主族元素的氢化物,相对分子质量越大,沸点越高,但是由于氨气中存在氢键,故氨气的沸点最高,其次是砷化氢,故A错误;
B、一般原子晶体熔点高于离子晶体,离子晶体高于分子晶体,由于Si3N4是原子晶体,故熔点最高,SiF4为分子晶体,故熔点最低,故B正确;
C、两种化合物均属于离子晶体,由于晶体中O2-半径小于S2-,则Cu2O的晶格能高于Cu2S,即熔点高于后者,故C正确;
D、元素的非金属性越强,其第一电离能越高,但是由于N元素的2p处于半充满状态,故第一电离能大于O,故D正确;
故选A;
(3)铜晶体中每个铜原子周围距离最近的铜原子数目=3×8×$\frac{1}{2}$=12;该晶胞中O原子数为4×1+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个,故答案为:12;16;
(4)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明阴离子的中心原子价层电子对个数是4且不含孤电子对,为硫酸根离子,阳离子呈轴向狭长的八面体结构(如图2所示),根据图象知,阳离子的配位数是6,阳离子中含有共价键、配位键,氨分子个数是4、水分子个数是2,其化学式为[Cu(NH3)4(H2O)2]SO4,故阳离子的化学式为:[Cu(NH3)4(H2O)2]2+,故答案为:[Cu(NH3)4(H2O)2]2+;
(5)将Cu单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,说明得到四氨合铜络离子,还应生成氢氧根离子与水,该反应的离子方程式是2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O,故答案为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
(6)该反应每消耗1mol CuCl(s),放热44.4kJ,消耗4mol CuCl(s),则放热44.4kJ×4=177.6kJ,根据热化学方程式的书写方法,可以写出该反应的热化学方程式为4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol,故答案为:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、分子结构、配合物、晶胞计算等,推断元素是解题关键,注意掌握中学常见配合物,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 正戊烷分子中的最多有5个原子在同一平面上 | |
| B. | 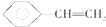 分子中最多有8个原子在同一平面上 分子中最多有8个原子在同一平面上 | |
| C. | CH2=CH-CH=CH2所有原子可能在同一直线上 | |
| D. | 2-丁烯(CH3CH=CHCH3)分子中4个碳原子可能在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 现象 | 结论 |
| A | KIO3溶液中滴加HI,再滴加淀粉溶液 | 溶液出现蓝色 | KIO3氧化性比I2强 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 将一小块Na放入乙醇中 | 产生气泡 | 乙醇含有羟基 |
| D | 沿杯壁向水中加浓H2SO4,搅拌 | 烧杯外壁发烫 | 浓硫酸溶于水放热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯酚能与NaOH溶液反应,而乙醇不行 | |
| B. | 丙酮(CH3COCH3)分子中的氢比乙烷分子中的氢更易被卤原子取代 | |
| C. | 乙烯可发生加成反应,而乙烷不能 | |
| D. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融AlCl3 | B. | 加热CaCO3 | ||
| C. | 电解熔融NaCl | D. | 氯化钠与铝粉高温共热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com