
| A. | 给试管中的液体加热时,试管口不准对着别人,但可以对着自己 | |
| B. | 玻璃仪器都可以用于加热 | |
| C. | 在H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜 | |
| D. | 无论给试管中的液体还是固体加热,都必须先预热 |
分析 A.用试管加热液体时,试管口不可以对着自己,也不能对着别人;
B.依据常见仪器使用方法解答;
C.防止氢气混有试管中的空气而不纯,加热会爆炸;
D.加热时,应先预热后集中试管底部加热.
解答 解:A.加热时,试管口不可以对着自己,也不能对着别人,以防液体沸腾溅出伤人,故A错误;
B.玻璃仪器不都可以用于加热,例如量筒、容量瓶不能用于加热,故B错误;
C.防止氢气混有试管中的空气而不纯,加热会爆炸,氢气还原氧化铜时先通氢气后加热,故C错误;
D.加热时,应先预热后集中试管底部加热,防止受热不均,引起试管炸裂,故D正确;
故选:D.
点评 本题考查化学实验的基本操作,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解题关键,题目难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2中含有的分子数为NA | |
| B. | 标准状况下,22.4 L H2O中含有的分子数为NA | |
| C. | 1 mol Mg与足量O2反应转移的电子数为NA | |
| D. | 1 mol钠原子中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、淀粉、硝化纤维、油脂都属于高分子化合物 | |
| B. | 聚丙烯能使溴水褪色 | |
| C. | 氯丁橡胶在空气中燃烧只生成CO2和H2O | |
| D. | 利用木材作原料制得的纤维是人造纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入等物质的量的Cl2:Cl2+2Br-=2 Cl-+Br2 | |
| B. | 4mol/L NaAlO2溶液和7mol/L盐酸等体积均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ | |
| C. | 向NaAlO2 溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
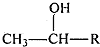
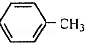 $\stackrel{KMnO_{4},H+}{→}$
$\stackrel{KMnO_{4},H+}{→}$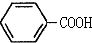
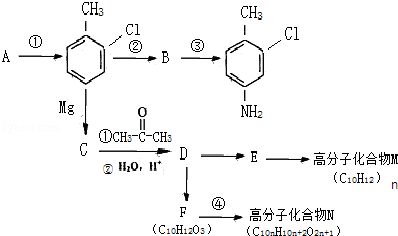
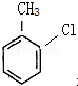 这一途径外,另一途径生成的中间产物的结构简式为
这一途径外,另一途径生成的中间产物的结构简式为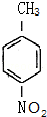 ,假定每次反应所得可能产物的机会是均等的,试分析,当消耗等量反应物时题中(填“题中”或“另一”)途径获得B的产量更高;
,假定每次反应所得可能产物的机会是均等的,试分析,当消耗等量反应物时题中(填“题中”或“另一”)途径获得B的产量更高;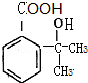 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$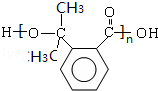 +(n-1)H2O;
+(n-1)H2O;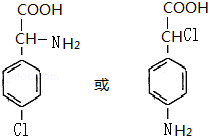 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com