
 .
.分析 (1)Ge是32号元素,核外电子数为32,根据构造原理书写其基态原子核外电子排布式;
(2)乙烯(C2H4)分子每个C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式;
(3)原子晶体硬度较大,原子晶体中微粒间的作用力是共价键;
(4)可燃冰中只有水分子之间能形成氢键;
(5)等电子体的结构相似,故O22+的电子式与C22-的电子式相似;
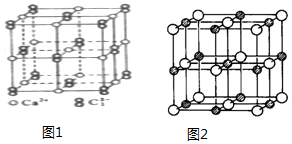
(6)以最中心钙离子为例,Ca2+周围距离最近且等距离的C22-分布在这个钙离子同一层的正方形的棱边的中点上,由于晶胞沿一个方向拉长,所以上底面面心上和下底面面心上的两个C22-与钙离子的距离大于同一层上的4个C22-与钙离子的距离;
图2中白色球表示Na+,图中Na+位于晶胞的8个顶点、6个面上.
解答 解:(1)Ge是32号元素,核外电子数为32,基态原子核外电子排布式为:[Ar]3d104s24p2,
故答案为:[Ar]3d104s24p2;
(2)乙烯(C2H4)分子每个C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp2,故答案为:sp2;
(3)氮化碳的硬度较大,说明氮化碳为原子晶体,氮化碳中存在共价键,
故答案为:原子晶体;共价键;
(4)可燃冰中只有水分子之间能形成氢键,所以只能形成一种氢键,
故答案为:1;
(5)根据等电子体原理可知,O22+的电子式  ,故答案为:
,故答案为: ;
;
(6)以最中心钙离子为例,Ca2+周围距离最近且等距离的C22-分布在这个钙离子同一层的正方形的棱边的中点上,由于晶胞沿一个方向拉长,所以上底面面心上和下底面面心上的两个C22-与钙离子的距离大于同一层上的4个C22-与钙离子的距离,所以1个Ca2+周围距离最近的C22-有4个,图2中白色球表示Na+,图中Na+位于晶胞的8个顶点、6个面上,属于面心立方最密堆积,
故答案为:4;面心立方最密堆积.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、电子式书写、氢键、原子杂化等知识点,侧重考查学生对物质结构、原子结构的认识及空间想象能力,掌握晶胞计算方法、价层电子对互斥理论,题目难度不大.


科目:高中化学 来源: 题型:解答题
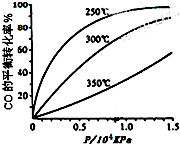 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O | |
| B. | Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→CH2Br-CH2Br | |
| D. | 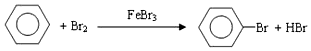 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.6mol | B. | 等于1mol | ||
| C. | 大于0.6mol小于1mol | D. | 小于0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 L CCl4、CO2含有的分子数为NA | |
| B. | 通常状况下,NA个CO2分子占有的体积约为22.4 L | |
| C. | 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 碳酸钙与稀硝酸的反应:CO32-+2H+═CO2+H2O | |
| C. | 铜与稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+OH-═Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com