
| A�� | Q1+Q2+Q3 | B�� | 0.5��Q1+Q2+Q3�� | ||
| C�� | 0.5 Q2-1.5 Q1-0.5Q3 | D�� | 1.5 Q1-0.5 Q2+0.5Q3 |
���� ���ø�˹���ɼ�3����֪�Ȼ�ѧ����ʽ����Ҵ�ȼ������Һ̬ˮʱ���Ȼ�ѧ����ʽ�������0.5mol�Ҵ�Һ����ȫȼ�շų���������
��� �⣺��H2O��g���TH2O��l����H1=-Q1kJ/mol
��C2H5OH��g���TC2H5OH��l����H2=-Q2kJ/mol
��C2H5OH��g��+3O2��g���T2CO2��g��+3H2O��g����H3=-Q3kJ/mol
���ݸ�˹���ɣ��١�3-��+�۵õ���C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-��3Q1-Q2+Q3��kJ/mol������0.5mol�Ҵ�Һ����ȫȼ�գ����ָ������£������������зų�������Ϊ��1.5Q1-0.5Q2+0.5Q3 ��KJ��
��ѡ��D��
���� ������Ҫ�����˹���ɵ�Ӧ�úͷ�Ӧ�ȵļ��㣬ע�⻯ѧ����ʽ�Ĵ����ǽ���Ĺؼ����ѶȲ���


 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش��������⣺
��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ��Ӧ��Cl2+H2O�T2H++Cl-+ClO- | |
| B�� | �������������Al��OH��3+3H+�TAl3++3H2O | |
| C�� | �������Ȼ�����Һ��Fe+Fe3+�T2Fe2+ | |
| D�� | �������ڴ��H++NH3�TNH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �Ȼ��� | C�� | �Ȼ��� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HX��HY��HZ������������ǿ | |
| B�� | ��Һ�е�����Ũ��c��X-����c��Y-����c��Z-�� | |
| C�� | ���볣��K��HY����K��HZ����ˮ�ⳣ��K��Y-����K��Z-�� | |
| D�� | c��X-��=c��Y-��+c��HY��=c��Z-��+c��HZ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϡH2SO4�����۷�Ӧ��2Fe+6H+=2Fe3++3H2�� | |
| B�� | �Ȼ�ͭ��Һ�����۷�Ӧ��Cu2++Fe=Fe2++Cu | |
| C�� | Mg������ķ�Ӧ��2Mg+2H+=2Mg2++H2�� | |
| D�� | ̼��������ᷴӦ��CO32-+2H+=H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ۢܢ� | C�� | �ڢۢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���õ绯ѧԭ������������һ�ַ����ǰѱ�����������Ϊ����������һ��������õĽ�����Ϊ���� | |
| B�� | ijһ���������Է��Ļ�ѧ��Ӧ������S��0������Է���Ӧһ��Ϊ���ȷ�Ӧ | |
| C�� | �ı�������ʹ��ѧƽ���������ƶ�����Ӧ���ת���ʲ�һ������ | |
| D�� | ���ڷ�Ӧ2NH3��g��?N2��g��+3H2��g������С�������ѹǿ����Ӧ��������������Ӱٷ������������ı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 C��CH3CH�TCHCH2OH D��
C��CH3CH�TCHCH2OH D��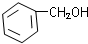
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com