
| A. | 0.1mol•L-1NaHCO3溶液:H+、Al3+、Cl-、CH3COO- | |
| B. | 0.1mol•L-1CuCl2溶液:K+、NH4+、OH-、S2- | |
| C. | 0.1mol•L-1FeCl2溶液:Na+、NH4+、I-、SO42- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液:Fe3+、Na+、SO32ˉ、NO3- |
分析 A.与HCO3-反应的离子不能大量共存;
B.与Cu2+反应的离子不能大量共存;
C.离子之间不发生任何反应;
D.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液呈酸性.
解答 解:A.Al3+与HCO3-发生互促水解反应,且H+、CH3COO-反应生成弱酸,不能大量共存,故A错误;
B.S2-与Cu2+反应生成沉淀,NH4+、OH-反应生成一水合氨,不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液呈酸性,酸性条件下SO32-、NO3-发生氧化还原反应,故D错误.
故选C.
点评 本题考查离子的共存,为高考高频考点,侧重氧化还原反应的离子共存问题的考查,注意信息的抽取和应用,选项D为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做过木炭还原氧化铜实验的硬质玻璃管(盐酸) | |
| B. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| C. | 做过碘升华实验的试管(酒精) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净酸式滴定管后,立即装入标准盐酸进行滴定 | |
| B. | 锥形瓶用待测NaOH溶液润洗后,再装入NaOH 溶液进行滴定 | |
| C. | 操作过程中,滴定前平视读数,滴定后仰视读数 | |
| D. | 用酚酞作指示剂滴至红色刚退去,停止滴沄,立即读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度/(mol•L-1) | NaOH物质的量浓度/(mol•L-1) | 混合溶液的pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 可用酒精洗涤沾有苯酚的试管 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有碳碳双键,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 苯中混有苯酚,加浓溴水,然后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
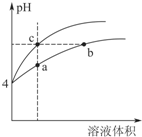 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.室温下:Ka(CH3COOH)=1.7×10-5 mol/L;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1| 实验编号 | 氢氧化钠溶液的浓度 (mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com