
分析 (1)先计算出氧气减少的物质的量,然后利用方程式计算出2min内二氧化硫减少、三氧化硫增加的物质的量;
(2)根据n=$\frac{\frac{△n}{V}}{△t}$计算出用O2的浓度变化来表示该反应的反应速率;
(3)根据化学反应速率与计量数成正比计算出用SO3的浓度变化来表示该反应的反应速率.
解答 解:(1)反应2min后,测得O2的物质的量为0.8mol,则氧气的物质的量变化为:1mol-0.8mol=0.2mol,根据反应方程式2SO2+O2?2SO3可知,二氧化硫减少的物质的量为:0.2mol×2=0.4mol,三氧化硫增加的物质的量为:0.2mol×2=0.4mol,
故答案为:0.4mol;0.4mol;
(2)用O2的浓度变化来表示该反应的反应速率为:v(O2)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(3)反应速率之比等于化学计量数之比,则v(SO3)=2v(O2)=2×0.05mol/(L•min)=0.1mol/(L•min),
故答案为:0.1mol/(L•min).
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率的概念及表达式为解答关键,注意掌握化学反应速率与化学计量数的关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
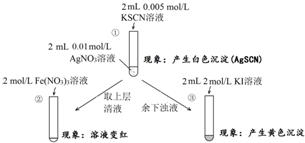
| A. | ①浊液中存在平衡:AgSCN(s)?Ag+(aq)+SCN-(aq) | |
| B. | ②中颜色变化说明上层清液中含有SCN- | |
| C. | ③中颜色变化说明有AgI生成 | |
| D. | 该实验可以证明AgI比AgSCN更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请按要求回答下列问题.
请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
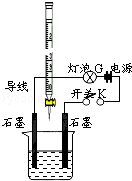 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
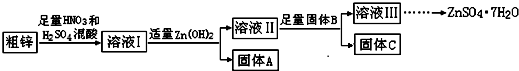
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
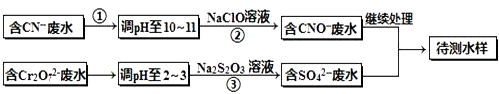
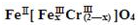 (铁氧磁体,罗马数字表示元素价态)的沉淀.
(铁氧磁体,罗马数字表示元素价态)的沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
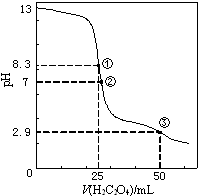 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com