
科目:高中化学 来源: 题型:解答题
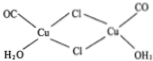 镍和铜都是重要的有色金属材料,回答下列问题:
镍和铜都是重要的有色金属材料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中的二氧化碳接触,生成 了乳白色的凝胶状沉淀(用H2SiO3表示)和碳酸钠的缘故 | |
| B. | 水的物理性质十分特殊.水的比热容较大,水结成冰后密度变小,水的熔沸点较高等特殊 性质是由于水分子间存在一种被称为氢键的特殊的分子间作用力 | |
| C. | 铅蓄电池是最常见的二次电池,由于它的性能优良、价格低廉、安全可靠,可多次充放电,所以使用广泛,但铅蓄电池也存在比能量低,废弃电池污染环境等缺点 | |
| D. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在 游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材 料,最有潜力的应用是成为硅的替代品,用来生产未来的超级计算机 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,NH4Cl溶液加水稀释过程中,$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$数值增大 | |
| B. | O.lOOOmol•L-1 的醋酸钠溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000mol•L-1 | |
| C. | 室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,则Ka1(H2CO3)×Ka2(H2CO3)<K | |
| D. | 室温,Ka(CH3COOH)=l.76×l0-5,Kb(NH3•H2O)=1.76×lO-5.则CH3COONH4溶液中存在:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-)>c(NH3•H2O)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 | |
| C. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| D. | 用合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
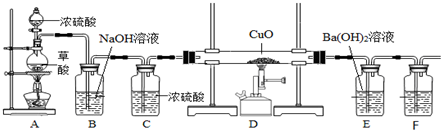
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物XZ2中,各原子均满足8电子的稳定结构 | |
| B. | 元素X与氢元素能形成原子数目之比为1:1的化合物 | |
| C. | Y的单质与稀硫酸、浓硫酸均可发生氧化还原反应 | |
| D. | Z的单质在加热条件下会与Fe反应生成Fe3Z4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2:3 | B. | 2:1:4:6 | C. | 2:1:4:3 | D. | 1:1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com